Name: Koch, Johanna 2017-06
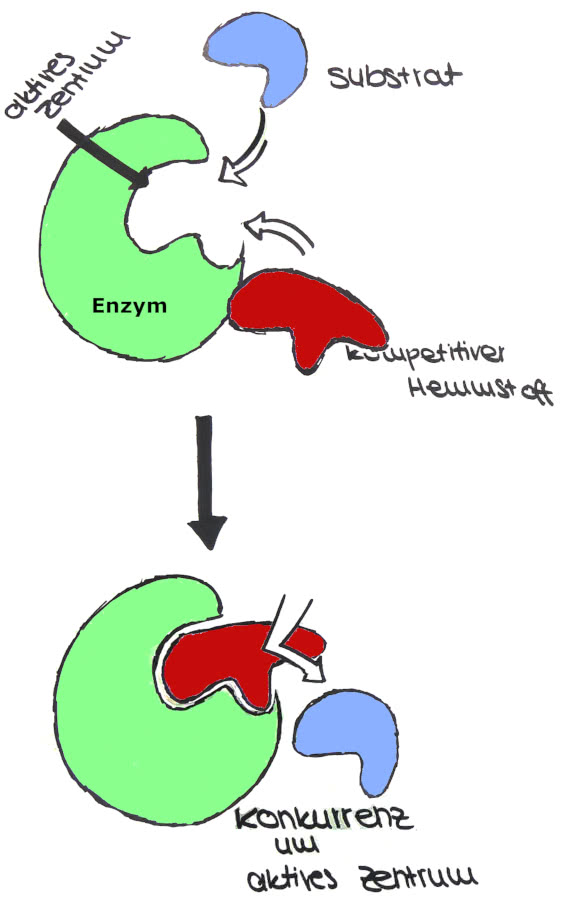
1. Kompetitive Enzym-Hemmung
Bei der kompetitiven Enzymhemmung ähnelt der Inhibitor (=Hemmstoff) dem Substrat in seiner dreidimensionalen Struktur. Es kommt zu einer Konkurrenzreaktion zwischen dem Substrat und dem kompetitiven Hemmstoff um die Bindung am aktiven Zentrum. Bindet der Inhibitor am aktiven Zentrum, blockiert er es für das Substrat, welches nun nicht mehr nach dem Schlüssel-Schloss-Prinzip binden.
Das betroffene Enzym kann nun keine Substrate mehr umsetzten. Liegen mehrere Enzyme vor, so können die blockierten Enzyme keine Substrate mehr umsetzen. Die Reaktionsgeschwindigkeit der Enzymreaktion nimmt ab.
Diese Hemmung ist jedoch reversibel. Durch eine Erhöhung der Substratkonzentration kann der Hemmstoff nach und nach aus den aktiven Zentren verdrängt werden, so das trotz des Inhibitors die maximale Geschwindigkeit erreicht werden kann.
2. Nichtkompetitive Enzym-Hemmung
Bei der nichtkompetitiven Enzymhemmung ähnelt der Hemmstoff dem Substrat nicht. Er bindet, anders als ein kompetitiver Hemmstoff, an einer beliebigen Stelle des Enzyms. Durch diesen Vorgang wird die räumliche Struktur des aktiven Zentrums so verändert, dass das Substrat nicht mehr nach dem Schlüssel-Schloss-Prinzip binden kann; es passt nicht mehr in die vorgesehene Andockstelle.
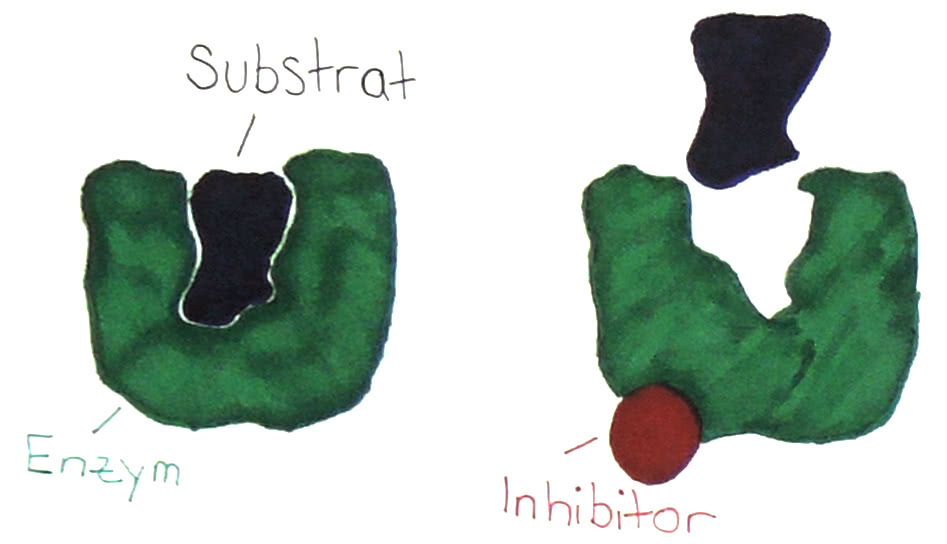
Das Enzym ist nun dauerhaft inaktiviert und denaturiert. Somit sind insgesamt weniger Enzym-Substrat-Komplexe vorhanden und die Reaktionsgeschwindigkeit nimmt wie bei der kompetitiven massiv Hemmung ab.
Da aber keine Konkurrenz um das aktive Zentrum vorliegt, kann eine höhere Konzentration an Substrat die nichtkompetitive Hemmung nicht aufheben.
3. Allosterische Enzym-Hemmung
Die allosterische Enzymhemmung ist der nichtkompetitive Hemmung sehr ähnlich. Der allosterische Hemmstoff ähnelt ebenfalls dem Substrat nicht und bindet auch nicht im aktiven Zentrum. Ein allosterischer Inhibitor bindet im extra vorgesehenen allosterischen Zentrum des Enzyms (reversibel, also nicht dauerhaft). Die weitere Reaktion verläuft wie bei der nichtkompetitiven Hemmung beschrieben: Das aktive Zentrum wird verformt und das Enzym kann, solange der allosterische Hemmstoff gebunden ist, kein weiteres Substrat umsetzen.

Eine besondere Form der allosterischen Hemmung ist die Endprodukthemmung (auch: Rückkopplungshemmung). Bei dieser Hemmung reagiert das aus dem Substrat entstandene Produkt als allosterischer Hemmstoff und hemmt (solange es vorhanden ist) das Enzym.Erst wenn nicht mehr genügend Produkt im Körper vorliegt, verlassen die letzten Produkte die allosterische Andockstelle, so dass die Enzyme wieder aktiv werden und Produkt nachbilden können.
So kann ein Organismus beispielsweise seinen Stoffwechsel selbst regeln und eine Überproduktion an Produkten verhindern.
Versuch: Urease setzt Harnstoff um (mit Hemmung)
Ein Beispiel zum besseren Verständnis der Enzymhemmung:
Es wird ein Versuch zur Enzymhemmung am Beispiel von Urease, welche Harnstoff, aber nicht Thioharnstoff spaltet, durchgeführt:
Versuch A zeigt die gemessene Reaktionsgeschwindigkeit (Stoffmengenumsatz pro Zeiteinheit) der Harnstoffzersetzung durch Urease.
Versuch B zeigt den gleichen Versuch, allerdings befindet sich im Gefäß nicht nur Harnstoff, sondern der chemisch sehr verwandte Thioharnstoff
Versuch C Zeigt die Umsetzung von Harnstoff durch Urease in gegenwart von Bleiionen (Pb2+)
Beobachtung:
Erklärung der gemessenen Kurven:
A) Das Enzym Urease spaltet Harnstoff in Ammoniak (NH3) und Kohlenstoffdioxid (CO2). Bei steigender Harnstoffkonzentration, also Substratkonzentration, steigt auch die Reaktionsgeschwindigkeit und nähert sich einem Sättigungswert an. Liegen alle Enzym-Moleküle als Enzym-Substrat-Komplex vor, ist die maximale Geschwindigkeit der Enzymreaktion erreicht.
B) Bei gleicher Reaktion wie bei A mit Anwesenheit von Thioharnstoff verläuft die Kurve zu Beginn flacher. Bei sehr hoher Harnstoffkonzentration steigt die Kurve jedoch an und erreicht die gleiche Reaktionsgeschwindigkeit wie Reaktion A. Das bedeutet, dass bei niedriger Harnstoffkonzentration die Enzymreaktion mit Anwesenheit von Thioharnstoff deutlich langsamer abläuft und dass bei hoher Konzentration von Harnstoff die maximale Geschwindigkeit der Reaktion trotzdem erreicht wird.
Da der Thioharnstoff eine ähnliche dreidimensionale Struktur wie der Harnstoff aufweist, passt er in das aktive Zentrum des Enzyms Urease. Es entstehen Enzym-Inhibitor-Komplexe. Der Thioharnstoff kann jedoch nicht umgesetzt werden, da Enzyme substratspezifisch sind. Dies bedeutet, dass die Enzyme nur bestimmte Substrate spalten und zu neuen Produkten umsetzen. Zudem entstehen bei einem Enzym immer die gleichen Produkte (Wirkspezifität).
Der Kurvenverlauf ist so zu erklären, dass bei geringer Harnstoffkonzentration zunächst viele Enzyme durch den Thioharnstoff inaktiviert werden, da das aktive Zentrum blockiert ist und sich weniger Enzym-Substrat-Komplexe bilden. Wird mehr Harnstoff dazugegeben verdrängt es den Inhibitor, also den Thioharnstoff.
Aufgrund der genannten Eigenschaften des Enzymreaktionsverlaufes sowie dem gegebenen Kurvenverlauf ist darauf zu schließen, dass bei B eine kompetitive Hemmung abläuft und der Thioharnstoff als kompetitiver Inhibitor fungiert.
C) Werden Blei-Ionen dazu gegeben, findet fast keine Reaktion statt. Die Blei-Ionen agieren als nichtkompetitiver Hemmstoff. Sie binden an eine beliebige Stelle des Enzyms an und verändern so die Struktur des aktiven Zentrums. Der Harnstoff kann nicht mehr nach dem Schlüssel-Schloss-Prinzip binden. Das Enzym denaturiert.