Name: Hannah Müller, 2020-12
Was ist Isomerie?
Es gibt viele Formen der Isomerie (siehe auch hier: "Isomerieformen"), denen gemeinsam ist, dass sich die Strukturformel trotz gleicher Summenformel unterscheidet.
Neben der Konstitutionsisomerie, welche sich auf unterschiedliche Strukturformeln (Konstitution) trotz gleicher Summenformel bezieht, gibt es auch die Stereoisomerie. Kennzeichnend für diese ist die gleiche Konstitution, aber eine unterschiedliche räumliche Anordnung der Atome bzw. Moleküle.
Die Stereoisomerie kann wiederum in die Konformationsisomerie (Molekül ist durch Drehung um eine Einfachbindung umwandelbar) und die Konfigurationsisomerie (Molekül ist nur durch Neuknüpfen einer zuvor gespaltenen Bindung umwandelbar) unterteilt werden.
Letztere umfasst weitere Isomerietypen: Bei der Enantiomerie verhalten sich die Isomere wie Bild und Spiegelbild zueinander, bei der Diastereoisomerie aber nicht.
Zu weiteren Formen werden auch die Cis-/trans-Isomerie sowie die E-/Z-Isomerie zur Diastereoisomerie gezählt. Um diese geht es in diesem Artikel.
Isomeriearten - Schaubild
1) Cis-/trans-Isomerie
Liegt bei einem Alkan eine Einfachbindung vor, so sind die Atome um diese Bindungsachse frei drehbar, wodurch die klassischen Konstitutionsisomere entstehen. Alkene jedoch beinhalten eine Doppelbindung: Bei unterschiedlicher Anordnung der einzelnen Substituenten (= Atom (-gruppe), das/ die ein Wasserstoffatom ersetzt, in diesem Fall also an die C-Atome der Doppelbindung bindet/n) an dieser handelt es sich nicht um Konstitutionsisomere, da diese nicht durch Drehung an der Doppelbindung auseinander entstehen können. Folglich beschäftigt sich die Cis-/trans-Isomerie mit der Konfiguration (räumlichen Anordnung der Atome) von Alkenen/ Alkinen.
Möchte man nun ein Alken auf Cis-/trans-Isomerie untersuchen, so ist folgendes zu beachten:
1. Die Bezeichnungen Cis und Trans beziehen sich auf die Anordnung gleicher Substituenten im Verhältnis zueinander.
2. Es wird überprüft, ob diese Substituenten auf der gleichen Seite (cis = lat. diesseits) oder entgegengesetzt zueinander (trans = lat. jenseits) liegen. Die „Seiten“ liegen oberhalb und unterhalb der Doppelbindung, also parallel zu dieser.
2) E-/Z-Isomerie
Im Gegensatz zur Cis-/trans-Isomerie kann die E-/Z-Isomerie auch dann angewendet werden, wenn unterschiedliche Substituenten vorliegen. Da sie somit allgemeiner und eindeutig anwendbar ist, wird sie heutzutage bevorzugt. Bei der Nomenklatur gelten die CIP (Cahn-Ingold-Prelog) – Prioritätsregeln, welche die Prioritäten von verschiedenen Substituenten festlegen:
Priorität haben…
- Atome mit höherer Ordnungszahl
◦ (wenn dieser Punkt nicht angewendet werden kann, müssen die Atome innerhalb von Atomgruppen verglichen werden!)
◦ Auflistung der häufigsten Atomreste nach Priorität aufgrund der Ordnungszahl: I > Br > Cl > S > P > F > O > N > C > H - Isotope mit größerer Atommasse
- Niedrigste Priorität haben immer: freie Elektronenpaare
Bei der Bestimmung von E/ Z ist folgendermaßen vorzugehen:
1. Das Alken wird an der Doppelbindung in eine linke und eine rechte Hälfte geteilt.
2. Nun wird jeweils der Substituent mit der höheren Priorität bestimmt.
3. Jetzt werden beide Seiten zusammen betrachtet: liegen die in 2. Bestimmten Substituenten zusammen (Z) auf einer Seite der Doppelbindung (ober-/ unterhalb) oder liegen sie entgegengesetzt (E) zueinander?
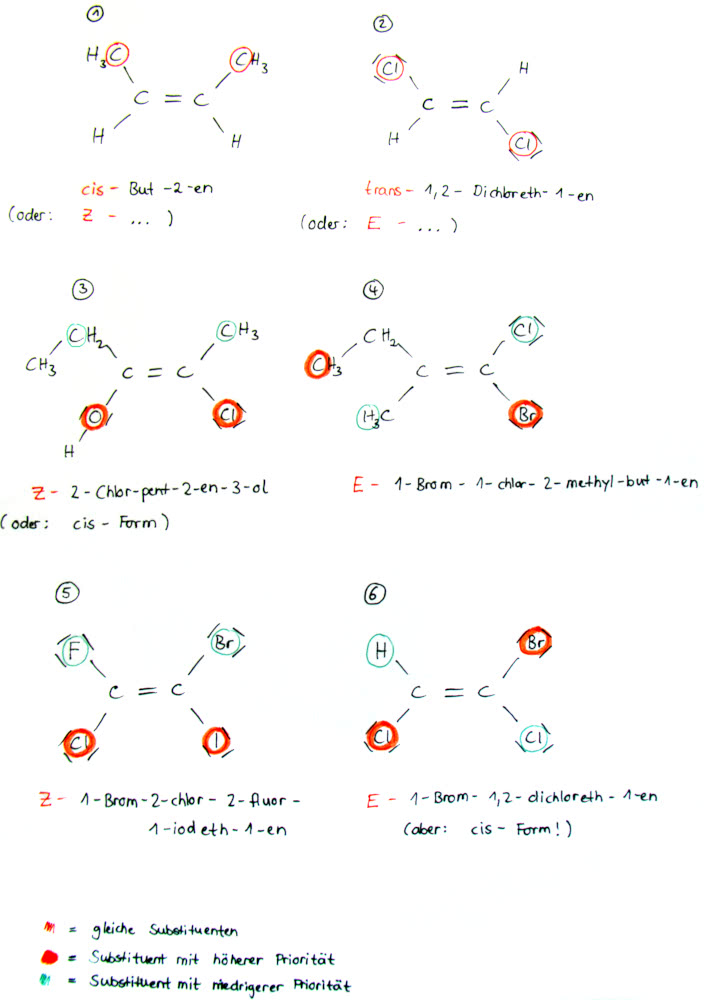
Cis-/ trans-Isomerie & E/Z-Isomerie Beispiele
Zur Erklärung:
- Bei Beispiel 1) liegt Z-Isomerie und bei Beispiel 2) E-Isomerie vor.
- Auf die Beispiele 3) und 4) kann jedoch die Nomenklatur der cis-/trans-Isomere nicht angewendet werden, da hier vier verschiedene Substituenten vorliegen!
- Beachte: Beispiel 5) verdeutlicht, dass E- und trans-Isomerie (bzw. Z- und cis-Isomerie) nicht unbedingt dasselbe sind!
Beachte: Sowohl cis-/ trans- als auch E-/Z-Isomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften.
Beispiele:
Trans-1,2-Dichlor-eth-1-en ist unpolar (Partialladungen fallen in einem Punkt zusammen),
Cis-1,2-Dichlor-eth-1-en ist aber polar (Partialladungen fallen nicht in einem Punkt zusammen).
Da zwischen letzteren Molekülen also Dipol-Dipol-Kräfte ausgebildet werden, liegt die Siedetemperatur im Vergleich zum Isomer höher.