Name: H. Schmitt
Was versteht man unter eine Elektrolyse?
Die Elektrolyse kann als das Gegenteil der Ionenbildung (Aus elementen werden Ionen) verstanden werden. Es werden aus Ionen Elemente gebildet.
Lyse heißt dabei "Spaltung". Bei der Elektrolyse wird mithilfe von Strom ein ionogener Stoff so zerlegt, dass dabei wieder seine Elemente entstehen. Aus Natriumfluorid wird also Natrium und Fluor.
Der ursprüngliche Stoff, oft ei Salz oder Oxid liegt als Flüssigkeit (geschmolzen) oder als Salzlösung vor. Man nennt dies auch einen Leiter 2. Ordnung. Es liegen also bewegliche Ladungsträger (= Ionen) vor.
Die Elektrolyse ist der endotherme Vorgang zur Umwandlung von Ionen in Elemente. Die dabei gewonnen Elemente sind oft chemisch sehr rein. Auf diesem Wege kann man gut unedle und reine Metalle herstellen.
Der Ablauf der Elektrolyse:
Nehmen wir einmal an, wir haben eine wässrige Salzlösung. In einen Behälter oder ein Becherglas kommen zwei Graphitstäbe rein, welche mit einer Gleichstromquelle verbunden sind. Der eine Graphitstab stellt die Anode da dar und ist positiv geladen (Anode ist griechisch und kommt von anodos, was Aufgang bedeutet). Der andere Stab ist die Kathode, welche negativ geladen ist (Kathode ist ebenfalls griechisch und kommt von kathodos, was abwärts führender Weg bedeutet).
An der Anode befinden sich die positiv geladenen Ionen (Definition siehe Ionen und Ionenbildung) welche mit einem + gekennzeichnet sind . Diese wandern in der wässrigen Salzlösung auf die gegenüberliegende Seite. An der Kathode, welche negativ geladen ist entladen sie sich, das heißt, sie nehmen ein Elektron auf und werden so zu ungeladenen Atomen, da sich die positive und die negative Ladung jetzt (wieder) ausgleichen.
An der Kathode befinden sich die negativ geladenen Ionen welche mit einem - gekennzeichnet sind. Diese wandern jetzt zur Anode, welche ja positiv geladen ist und geben ein Elektron ab und werden ebenfalls zu ungeladenen Atomen, da sich auch hier jetzt (wieder) die positive und die negative Ladung ausgleichen. Wichtig ist, das am Ende wieder Elemente gebildet werden. Dieser chemische Vorgang findet nur unfreiwillig statt. Energie muss also die ganze Zeit zugefügt werden. Man sagt auch, die Reaktion ist endotherm.
Die Elektrolyse ist also die Umkehrung der Ionenbildung. Wichtig ist, dass dies unfreiwillig geschieht, da die Ionen eigentlich gar nicht auseinander "wollen". Das heißt, es ist viel Energie notwendig, was zeigt, das Elektrolysen endotherme Reaktionen sind.
Beispiele für Elektrolysen
Natriumchlorid (Kochsalz) wird zuerst in Natrium = Na+ und Chlorid = Cl- zerlegt bzw. gespalten.
Im Kapitel Ionen und Ionenbildung haben wir erfahren, das bei der Ionenbildung das Natriumion ein Valenzelektron hat, welches es an Chlor abgibt, welches sieben Valenzelektronen besitzt. Somit haben Natrium und Chlor das Ziel der Edelgaskonfiguration erreicht, also eine volle Außenschale (meist acht Elektronen). Somit hat Natrium ein Elektron weniger als vorher und wird zum positiv geladenen Ion (+). Chlor hat ein Elektron mehr als vorher und wird zum negativ geladenen Ion (-).
Der folgende Schritt findet nun in einem Behälter mit zwei Graphitstäben statt. Der eine ist die Anode der andere die Kathode. Die Natriumionen wandern zur Kathode, wo sie sich entladen und ein negatives Elektron aufnehmen. Ihre Ladung ist ab jetzt wieder ausgeglichen, das heißt sie sind neutral geladene Natriumatome.
Die Chlorionen machen genau das Gegenteil. Sie wandern zur Anode, wo sie ein negatives Elektron abgeben und auch wieder zu ungeladenen Chloratomen werden. Durch die Schmelze und den elektrischen Strom sind aus Ionen wieder Atome geworden. Aus Natriumchlorid ist wieder Natrium und Chlor entstanden.
Reaktionsgleichung: Na+ + e- ---> Na 2Cl- ---> Cl2 + 2e-
Die Elektrolyse anhand Kupferchlorid zu Kupfer und Chlor
Wir haben wieder einen Behälter mit zwei Graphitstäben der Anode und der Kathode. An der Anode befinden sich die Kupferionen, welche posítiv geladen sind. Diese wandern zur Kathode. Dort entladen sie sich und nehmen ein negatives Elektron auf. Sie werden zu ungeladenen Kupferatomen. Die Chlorionen, welche negativ geladen sind wandern zur Anode, wo sie ein negatives Elektron abgeben. Sie werden zu ungeladenen Chlormolekülen. Somit ist wieder durch die Schmelze und den elektrischen Strom Kupfer und Chlor geworden. Hierbei wird wieder sehr viel Energie benötigt = endotherm und unfreiwillig =)
Reaktionsgleichung: 2Cl- ---> Cl2 + 2e-
Cu2+ + 2e- ---> Cu
------------------------------
2Cl- + Cu2+ ---> Cl2 + Cu
Ion + Ion ---> Element + Element
Eine besondere ANwendung kann hierbei übrigens die Verkupferung sein. Wenn man als Minuspol nicht eine Eltrode aus Graphit nimmt, sondern einen Metallschlüssel, wie den links im Bild, dann setzten sich auf diesem die blauen Kupferionen ab und reagieren durch die Elektronen zu elementarem Kupfer. Dieses bildet, wenn der Schlüssel gut gereinigt war, zu einem festem, rotbraunem Überzug!

Herstellung von Aluminium aus Bauxit in der Schmelzflusselektrolyse
(Bauxit entspricht weitgehend dem Aluminiumoxid (Al2O3)
Wir haben wieder einen Behälter mit einer Stromquelle, zwei Graphitstäben (Anode+ Kathode) und geschmolzenem Al2O3. Die Al3+-Ionen wandern zur Kathode, wo sie ein negatives Elektron aufnehmen und zu ungeladenen Aluminiumatomen werden. An der Anode befinden sich die Oxidionen. Es sind immer jeweils zwei, die zusammenhängen. An der Anode gehen immer vier e- nach oben bzw. sind bereit von den Aluminiumionen aufgenommen zu werden. Die Oxidionen wandern zur Anode, wo sie ein negatives Elektron abgeben und zu ungeladenen Oxidatomen werden.
Reaktionsgleichung:
ox: 2O2- ---> O2 + 4e- |*3
red: Al3+ + 3e- ---> Al |*4
----------------------------------------
Redox: 6O2- + 4Al3+ ---> 302 + 4Al
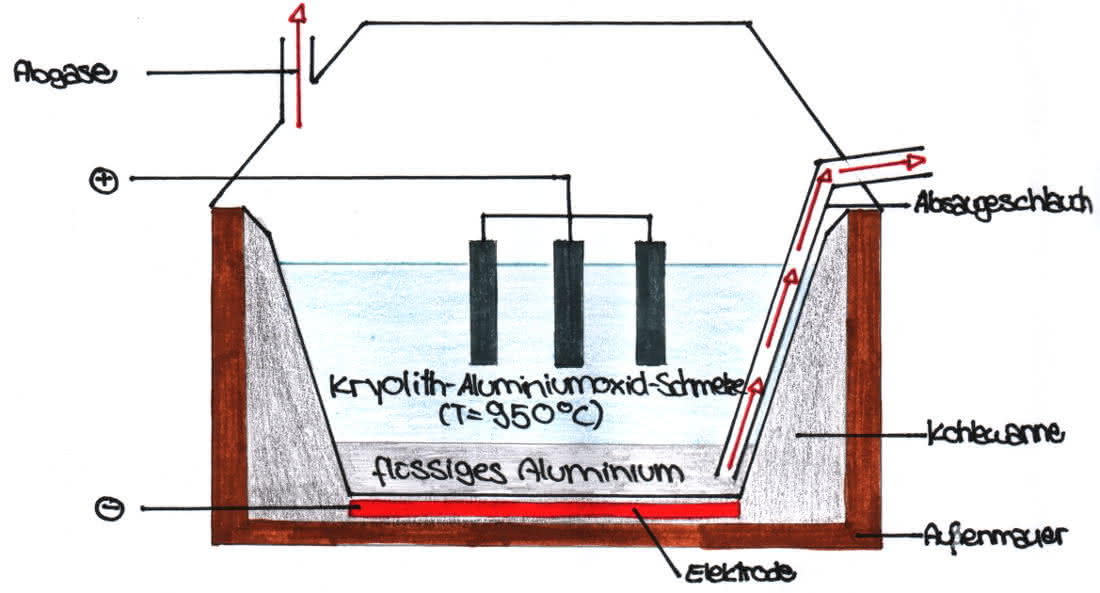
Skizze der Schmelzflusselektrolyse
