Name: Jana E. 2015
Carolin B: 2016-06
Salzsäure (HCl)
Herstellung von HCl im Labor:
Konzentrierte Schwefelsäure (H2SO4) wird aus einem Tropftrichter auf feuchtes Natriumchlorid (NaCl) getropft. Das entstehende Gas wird durch einen Schlauch zu einer Glasschale (gefüllt mit Universalindikator und Wasser) geleitet
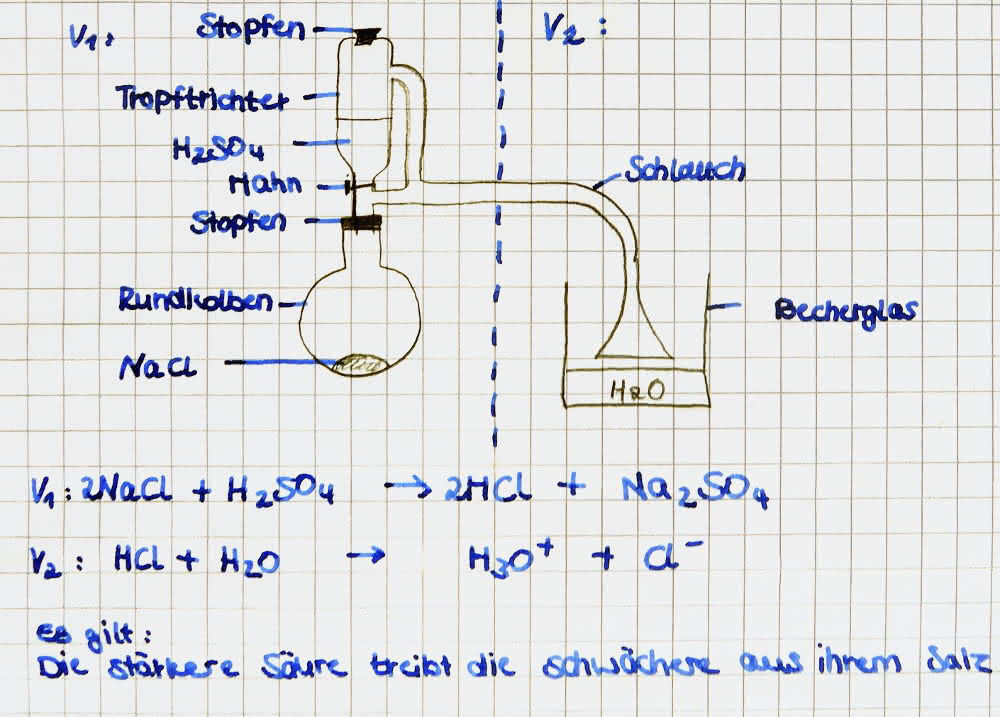
V1: H2SO4 + 2 NaCl --> 2 HCl + Na2SO4 + E
V2: HCl + H2O --> Cl- + H3O+ + E
Es gilt folgende generelle Regel: die stärkere Säure treibt die schwächere Säure (welche als Säurerest vorliegt - hier Cl-) aus ihrem Salz
Eigenschaften von HCl:
- löst sich in Wasser sehr gut
- Schmelz- und Siedetemperatur hängt von Zusammensetzung ab
- farblose Lösung
- penetranter Geruch
- verdampft beim Erhitzen komplett
Technische Herstellung von HCl:
HCl + H2O --> Cl- + H3O+
Eigenschaften der Chloride:
- farblose oder farbige Salze
- kommen in unterschiedlichen Kristallstrukturen vor
- hohe Schmelz- und Sidetemperaturen
- in Lösungen oder als Schmelzen leiten sie den elektrischen Strom
