Name: Raphael Kress, 2018-04
Name: Umed Danesch, Furkan Oktay 2019-11
Photovoltaik und Brennstoffzelle
Allgemeines zur Brennstoffzelle
Im Vergleich zu Wärmekraftwerken, welche einen Wirkungsgrad von ca. 40% besitzen, sind Stromerzeuger, welche auf galvanischen Zellen basieren, die einen Wirkungsgrad von bis zu 80% erreichen können, viel effektiver. Der Wirkungsgrad gibt dabei das Verhältnis von gewonnener zu aufgewendeter Energie an.
Die bei einer Redoxreaktion frei werdende Energie wird bei der galvanischen Zelle direkt in elektrische Energie umgewandelt. Dabei muss bei einer galvanischen Zelle der Brennstoff dauerhaft nachgeführt werden um über einen längeren Zeitraum Energie erzeugen zu können.
Aufbau der Brennstoffzelle:
siehe: https://commons.wikimedia.org/wiki/File:Brennstoffzelle_funktionsprinzip.png
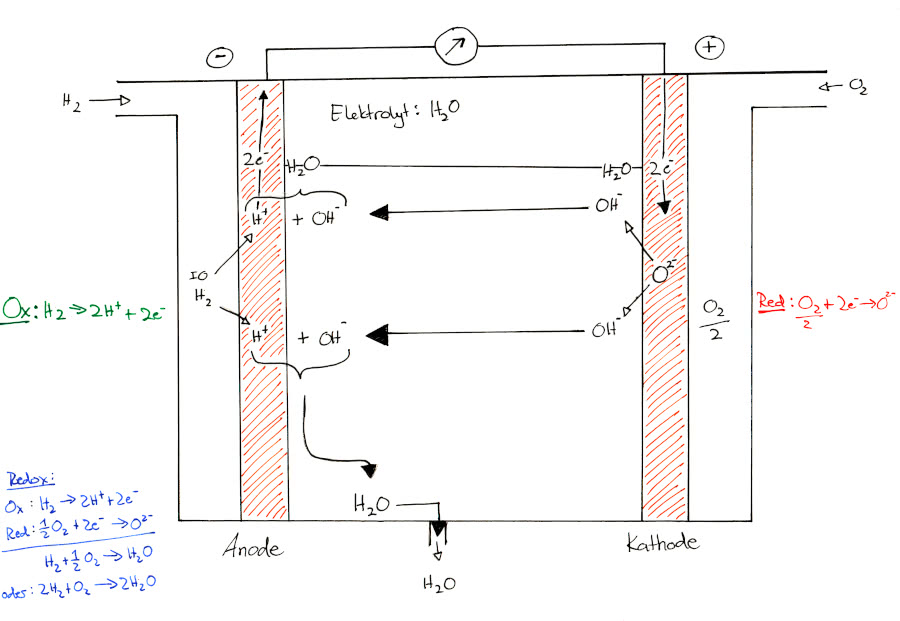
Die Brennstoffzelle besteht zunächst aus zwei Elektroden, meist aus Metall oder Kohlenstoff. Diese sind mit einem Katalysator, zum Beispiel Platin beschichtet. Die beiden Elektroden sind durch eine/n Elektrolytmembran/Elektrolyten voneinander getrennt. Diese ist nur für eine bestimmte Ionensorte durchlässig. Meist werden Laugen oder Säuren als Elektrolyten verwendet.
Chemische Funktionsweise einer Brennstoffzelle
In einer Wasserstoff/Sauerstoff-Brennstoffzelle wird die bei der stark exotherm ablaufenden Oxidation freiwerdende Energie genutzt:
2 H2 (g) + O2 (g) ----> 2 H2O (l)
Eine beispielhafte Brennstoffzelle ist die Protonenaustauschmembran-Brennstoffzelle (PEMFC), bei welcher Wasserstoff an der Anode katalytisch zu Protonen oxidiert wird, und Elektronen abgegeben werden. Über die Ionen-Membran gelangen die Protonen zur Kammer der Kathode. Die Elektronen hingegen gelangen über einen elektrischen Leiter und schließlich einen elektrischen Verbraucher zur Kathode, wo sie mit den ankommenden Protonen und zugeführtem Luftsauerstoff wieder zu Wasser reagieren (siehe Reaktion oben). Da die Membran in diesem Fall nur für Protonen durchlässig ist, spricht man von einem sauren Elektolyten.
Chemische Reaktionen der Brennstoffzelle (Redoxreaktionen)
Brennstoffzelle mit saurem Elektrolyten
Anode: Minuspol: 2 H2 (g) + 4 H2O(l) ----> 4 H3O+ (aq) + 4e- U=-0,87V
Kathode: Pluspol: O2 (g) + 4 H3O+ (aq) + 4e- ----> 6 H2O (l) U=0,36V
----------------------------------------------------------------------------------------
Gesamtreaktion: 2 H2 (g) + O2 (g) ----> 2 H2O (l) U=1,23V
Brennstoffzelle mit basischem Elektrolyten
Gleiches gilt für einen basischen Elektrolyten, welche aber mit hochreinem Sauerstoff und Wasserstoff arbeiten:
Anode: Minuspol: 2 H2 (g) + 4 OH-(aq) ----> 4 H2O (aq) + 4e- U=-0,87V
Kathode: Pluspol: O2 (g) + H2O (aq) + 4e- ----> 4 OH-(aq) U=0,36V
----------------------------------------------------------------------------------------
Gesamtreaktion: 2 H2 (g) + O2 (g) ----> 2 H2O (l) U=1,23V
Aus den Redoxreaktionen ergibt sich eine theoretische Spannung von 1,23 V, welche bei Standardbedingungen (25°C) erreicht werden könnte. Im Betrieb werden meist jedoch nur Spannungen von 0,5 V bis 1 V erreicht. Dabei ist die erzeugte Spannung von der Temperatur und der Qualität der Zelle abhängig. Um größere Spannungen zu erzeugen, werden oft mehrere Zellen zu einem "stack" in Reihe geschaltet.
Verwendung
Aufgrund der Vorteile wie zum Beispiel einem guten Wirkungsgrad, Klimafreundlichkeit und Herstellung elektrischer Energie, ohne viel Wärmeenergie zu erzeugen, bietet die Brennstoffzelle folgende Anwendungen:
1) Raketenantriebe
2) Schiffsantriebe
3) Unterwasserbootantriebe
4) Fahrzeuge mit Brennstoffzellen
Photovoltaik
Allgemeines
Photovoltaikanlagen erzeugen ebenfalls elektrischen Strom. Dieser Prozess basiert auf der Fähigkeit mancher Stoffe, Licht direkt in Strom umzuwandeln.
Aufbau und Funktionsweise
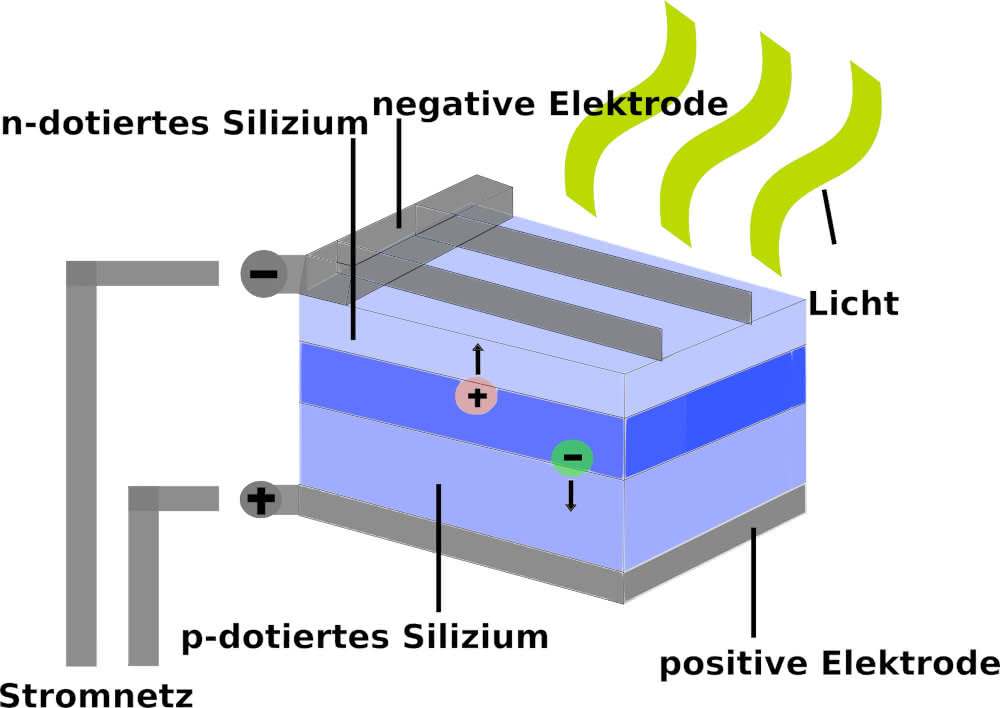
Die meisten Solarzellen basieren heutzutage auf Silizium, welches ein Halbleiter ist. Als Halbleiter bezeichnet man jene Stoffe, die sich sowohl wie ein elektrischer Leiter, als auch wie ein Nichtleiter verhalten, können. Das nicht leitende Material in der Solarzelle wird durch Absorption ("Aufnahme") eines Photons ("Lichtteilchen") zu einem Leiter, indem die Lichtenergie des Photons die Elektronen aus dem Kristallverbund lösen. Der erzeugte Strom besteht dann schließlich aus den sich bewegenden Elektronen. Die Photonenenergie, welche durch die Frequenz des Lichts charakterisiert ist, muss in einem gewissen vom Material abhängigen Bereich liegen. Daher können auch nur bestimmte Lichtfrequenzen für die Stromerzeugung genutzt werden.
Dotierung
Die Dotierung bezeichnet das Einfügen von Fremdatomen in eine Schicht eines Schaltkreises beziehungsweise eines Halbleiters. Bei der p-Dotierung werden Fremdatome in den Halbleiter implantiert, welche als Elektronen-Akzeptoren fungieren, während bei der n-Dotierung Elektronen-Donatoren implantiert werden.
Forschung
Die Forschung im Bereich der Photovoltaiktechnik ist trotz der Tatsache, dass das Phänomen bereits lange bekannt ist, noch lange nicht zu Ende. Es wird nach einem neuen Material gesucht, welches Silizium ersetzen kann. Dieses soll ein großen Teil des Lichtspektrums nutzbar machen und eine geringe Rekombinationsrate besitzen. Die Rekombinationsrate gibt an, wie schnell die Elektronen von einem leitenden in einen nicht leitenden Zustand wechseln. Der geringe Wirkungsgrad heutiger Solarzellen kommt deren hoher Rekombinationsrate zu Schulden.