Name: Marit, 2022-1
Einfluss des Katalysators auf das chemische Gleichgewicht
Allgemeine Bedeutung des Katalysators:
Katalysatoren werden heutzutage sehr vielseitig eingesetzt- sowohl in der Technik als auch in der Industrie (z.B. zur Herstellung vieler Grundchemikalien wie Ammoniak oder Schwefelsäure),und auch in der Umwelttechnik (z.B. Abgaskatalysatoren zur Verminderung von Schadstoffen) spielen Katalysatoren eine große Rolle.
Ein Katalysator beschleunigt die Reaktion, indem er die Aktivierungsenergie der Reaktion herabsetzt. Dies erreicht er, wenn er mit einem der Edukte eine oder mehrere Zwischenbindung(en) eingeht und so einen neuen Reaktionsweg mit einer niedrigeren Aktivierungsenergie schafft. Dadurch reagieren mehr Teilchen in gleicher Zeit, wodurch die Reaktionsgeschwindigkeit steigt. Ein weiteres Merkmal des Katalysators ist es, dass dieser am Ende einer Reaktion immer unverändert aus dieser hervorgeht, also selbst nicht reagiert hat.
Wichtige Katalysatoren sind z.B.
(1) Platin → wird als Abgaskatalysator eingesetzt, aber auch als Brennzellenkatalysator, der Oxidationsenergie in elektrische Energie umwandelt.
(2) Aluminiumoxid → wird bei der Haber-Bosch-Synthese zur Ammoniakgewinnung eingesetzt.
(3) Rhodium → zur Gewinnung von Salpetersäure.
(4) Vanadiumpentoxid → zur Gewinnung von Schwefelsäure.
Einfluss des Katalysators auf das chemische Gleichgewicht:
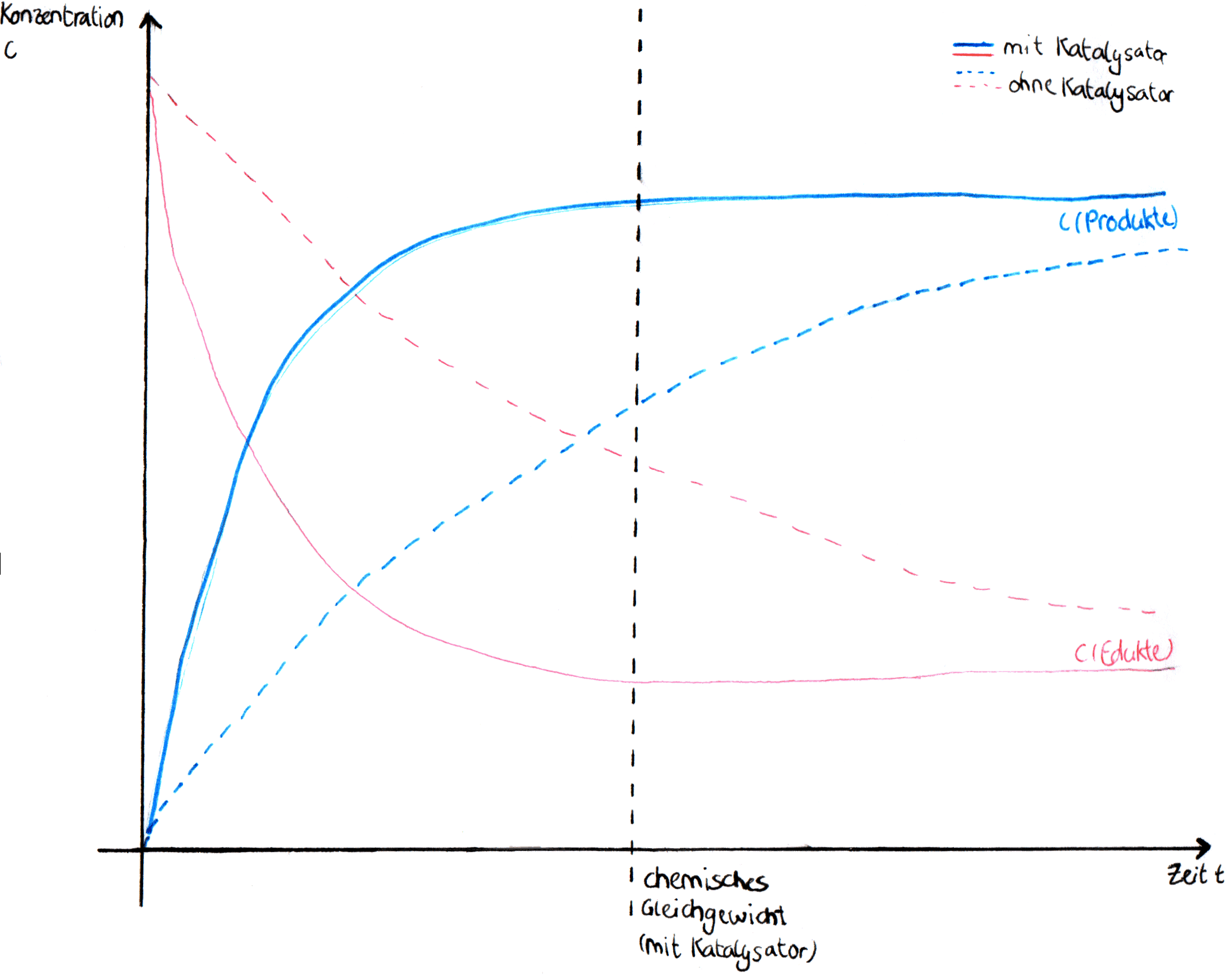
Auch bei einer Gleichgewichtsreaktion beschleunigt der Katalysator die Reaktionsgeschwindigkeit.
Der Katalysator senkt die Aktivierungsenergie von Hin- und Rückreaktion gleichermaßen, wodurch beide Reaktionen auch nach Zugabe des Katalysators weiterhin gleich schnell ablaufen. Dies führt dazu, dass das chemische Gleichgewicht schneller erreicht wird.
Dabei hat der Katalysator aber keine Auswirkung auf die Gleichgewichtszusammensetzung, wie es bspw. eine Temperaturänderung hätte. Er hat also keinen Einfluss auf die Gleichgewichtskonstante und die Lage des Gleichgewichts.
Lage des chemischen Gleichgewichts, mit und ohne Katalysator