Name: Theresa Funke, 2016-12
Stefan Wasmer, 2020-12
Killian Dehler, 2023-04
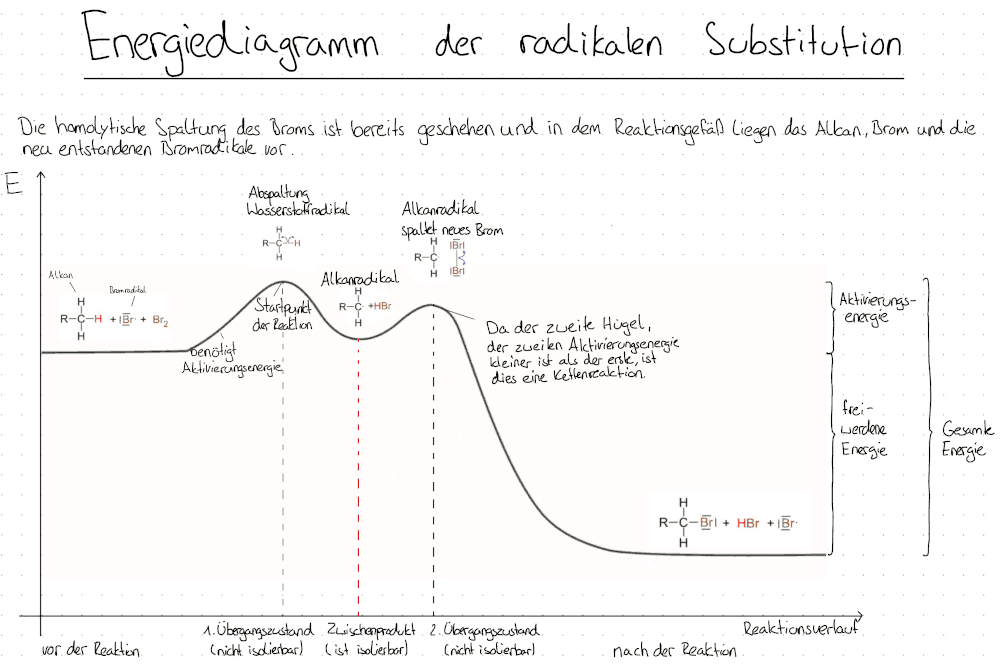
Ablauf der radikalischen Substitution
Definition: Die Radikalische Substitution ist ein Reaktionsmechanismus in der organischen Chemie (OC), der bis zu einem Abbruch der Reaktion fortgesetzt wird.
Er heißt "Radikalische" Substitution, da Radikale entstehen und sich verbinden. Zudem findet er unter Lichteinfluss statt.
Alkane sind eher Reaktionsträge, weswegen sie mit reaktionsfreudigen Stoffen wie Halogenen reagieren.
Hierbei entstehen (Halogen-)Radikale.
Die Reaktion startet nur durch Licht bzw. UV-Licht oder einer sehr hohen Temperatur und auch dann nur, wenn Radikale gebildet werden können, also wenn ein Halogen beteiligt ist. Dabei läuft sie um so schneller ab, je heller die Umgebung ist.
Wie der Name bereits erkennen lässt, wird bei diesem Reaktionsmechanismus substituiert, d.h. es erfolgt ein Austausch eines Atom oder einer Atomgruppe gegen ein anderes Atom oder einer anderen Atomgruppe.
Radikalische Substitutionen sind sehr wichtig, da durch diesen Reaktionsmechanismus in dem unpolaren Alkan polare Kohlenstoff-Halogen-Bindungen gebildet werden.

Radikalische Substitution: Hexan reagiert mit Brom
Die Radikalische Substitution läuft in drei Schritten ab:
I. Startreaktion
II. Kettenreaktion
III. Abbruchreaktion
I. Startreaktion:
Das Halogen wird homolytisch durch Licht (Energiequelle) in zwei Halogenradikale gespalten.
![]()
II. Kettenreaktion:
a) Das Halogenradikal aus I entreißt dem Alkan ein Wasserstoffradikal und bildet somit ein Alkylradikal.

b) Das Alkylradikal aus IIa spaltet weitere Halogenmoleküle homolytisch zu Halogenradikalen und verbindet sich mit einem von diesen. Es entsteht ein Halogenalkan und ein Halogenradikal.
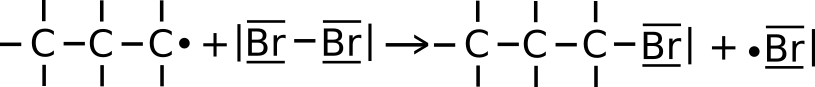
c) Das Halogenradikal aus IIb reagiert mit einem weiteren Alkan, solange bis es zu einem Abbruch kommt.
=> radikalischer Kettenmechanismus bzw. radikalische Substitution
III. Abbruchreaktion:
Die Kettenreaktion erfolgt solange bis es zur Abbruchreaktion kommt. Bei dieser gibt verschiedene Varianten:
Die Reaktion wird abgebrochen wenn:
- Es liegt kein Alkan oder Halogen mehr vor.
- Es reagieren zwei Radikale (zwei Halogenalkane/ zwei Alkanradikale/ ein Halogenradikal und ein Alkylradikal) miteinander (siehe Bilder).
Dies ist statistisch mit zunehmender Dauer der Reaktion wahrscheinlicher, da dann mehr Radikale in der Flüssigkeit vorhanden sind. - Zwei Alkylradikale treffen aufeinander.
- Ein Halogenradikal trifft auf ein Alkylradikal.
- Zwei Halogenradikale treffen aufeinander.
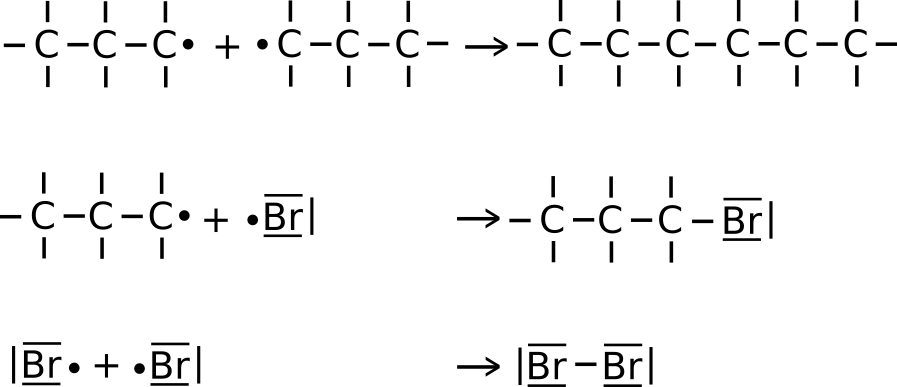
Beispiel einer radikalischen Substitution (Chlor reagiert mit Ethansäure zu Monochlorethansäure):
I. Startreaktion:
Das Chlormolekül wird unter Einfluss der Energiequelle Licht homolytisch in zwei Clorradikale gespalten.
![]()
II. Kettenreaktion:
a) Ein Chlorradikal aus I entreißt der Ethansäure ein Wasserstoffradikal. Hierbei entsteht Chlorwasserstoff und ein Ethansäureradikal.
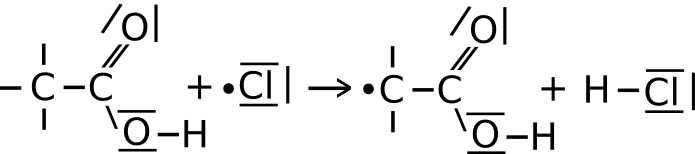
b) Das Ethansäureradikal aus IIa spaltet weitere Chlormoleküle homolytisch zu Chlorradikalen und verbindet sich mit einem dieser. Es entstehen Monochlorethansäure und ein Chlorradikal.
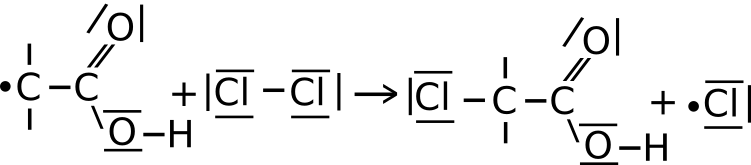
c) Das Chlorradikal aus IIb reagiert mit Ethansäure, solange bis es zu einem Abbruch der Reaktion kommt (vgl. III).
=> radikalischer Kettenmechanismus
III. Abbruchreaktion:
- Es ist kein Ethansäure oder Chlor mehr in der Flüssigkeit vorhanden.
- Es reagieren zwei Radikale miteinander (siehe Bild).
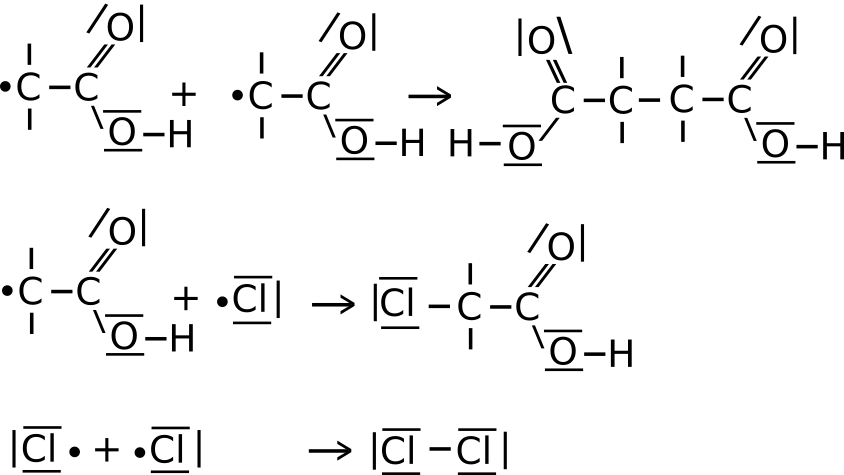
Den Ablauf der Reaktion könnt ihr in diesem Video sehen: https://youtu.be/APqf6UXbeRM
Das Energiediagramm der radikalischen Substitution