Name: Esra, 2017-06 , Lucas Röder 2021-06
Aufbau der Aminosäuren:
- Aminosäuren sind organische Verbindungen, die über mindestens eine Aminogruppe und eine Carboxylgruppe verfügen (chemisch gesehen sind sie primäre Amine, Formen des Ammoniak, der Carbonsäure und daher kommt auch ihr Name)
- sie unterscheiden sich durch einen Rest (R), welcher auch Seitenkette genannt wird -> dieser Rest legt fest, um welche Aminosäure es sich handelt und teilt die Aminosäuren wiederrum in Gruppen auf (sauer, basisch, polar, unpolar)
- unterscheidet sich der Rest R von den anderen Substituenten, die sich am Kohlenstoff mit der Amino-Gruppe befinden, so ist dieses Kohlenstoffatom chiral und es existieren von der entsprechenden Aminosäure zwei Enantiomere (Position der Seitenketten kann vertauscht werden) und wenn der Aminosäurerest weitere chirale Kohlenstoffatome enthält, so ergeben sich daraus auch Diastereomere
- in der Natur kommt von den beiden möglichen D- und L-Enantiomeren ausschließlich die L-Form vor, bei der in der Fischer-Projektion die Aminogruppe am C-Atom nach links weist.
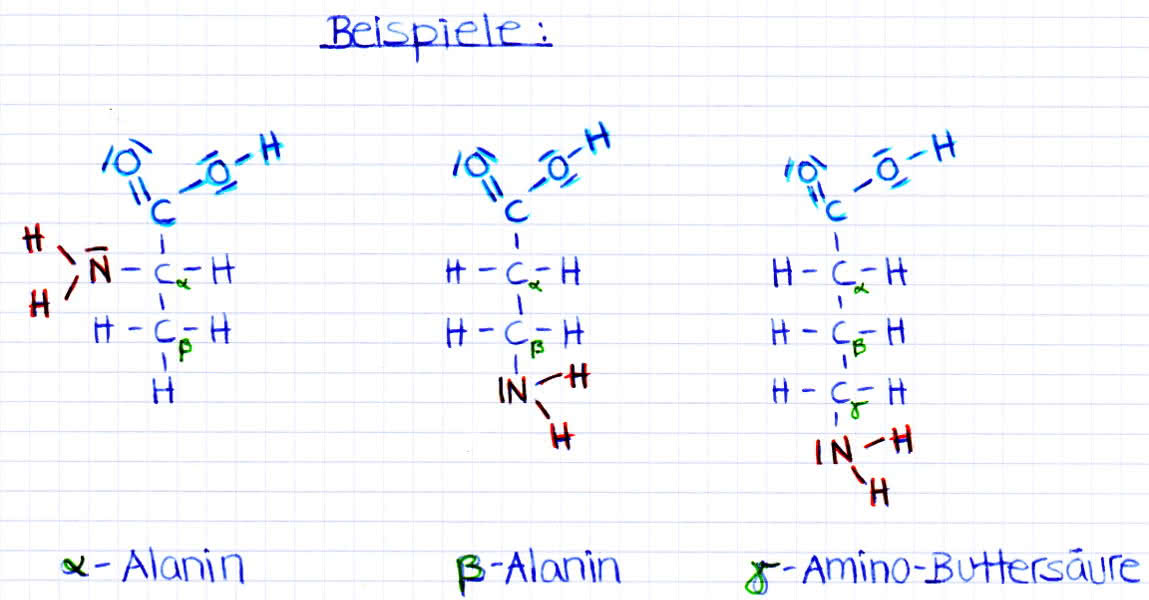
Aminosäuren. Alpha und beta Alanin sowie Gammaaminobuttersäure (Gaba)
Aminosäuren ...
- (veraltet auch Amidosäuren) werden manchmal als Synonym für proteinogene Aminosäuren verwendet, welche die Bausteine der Proteine sind
-proteinogenen Aminosäuren sind neben den Nukleinsäuren (DNA-Aufbau) (Cytosin,Guanin,Adenin,Thymin) Grundbausteine des Lebens
- es sind nur 23 proteinogene AS bekannt, das Spektrum der Aminosäuren ist jedoch um weites größer (250 nicht-proteinogene AS besitzen z.B biologische Funktionen und die Anzahl der synthetisch herstellbaren und theoretischen möglichen Aminosäuren ist noch einmal um ein Vielfaches größer)
- sind kristalline Feststoffe und können in wässriger Lösung den elektrischen Strom leiten
- sind aus Zwitterionen aufgebaut: Carboxylgruppe wirkt als Protonendonator und die Aminogruppe wirkt als Protonenakzeptor -> es kommt zu einer intramolekularen Protonenwanderung
- können als Ampholyte reagieren ( da die Carboxylgruppe sauer und die Aminogruppe basisch reagiert )
Aminosäuretypen:
- man unterscheidet zwischen 3 Klassen von Aminosäuren (Stellung der Aminogruppe zur Carboxylgruppe teilt auf in:α- , β- und γ-Aminosäuren)
- das C-Atom, das mit der Aminogruppe verbunden ist, bestimmt die Klasse der AS
- bei den α-Aminosäuren befindet sich die Aminogruppe am 2.Kohlenstoffatom (das Kohlenstoffatom der Carboxylgruppe wird mitgezählt) und die IUPAC-Nomenklatur würde somit 2-Aminocarbonsäure lauten (z.B Glycin)
- proteinogene AS bestehen hauptsächlich aus L-a-Aminosäuren und die α-Aminosäuren sind die in der Natur am häufigsten vorkommenden Aminosäuren
- bei den β-Aminosäuren befindet sich die Aminogruppe am 3.Kohlenstoffatom, die Nomenklatur lautet 3-Aminocarbonsäure (z.B ß-Alanin)
- bei den γ-Aminosäuren befindet sich die Aminogruppe am 4.Kohlenstoffatom, die Nomenklatur lautet 4-Aminocarbonsäure
Beispiele für L- und D-Aminosäuren:
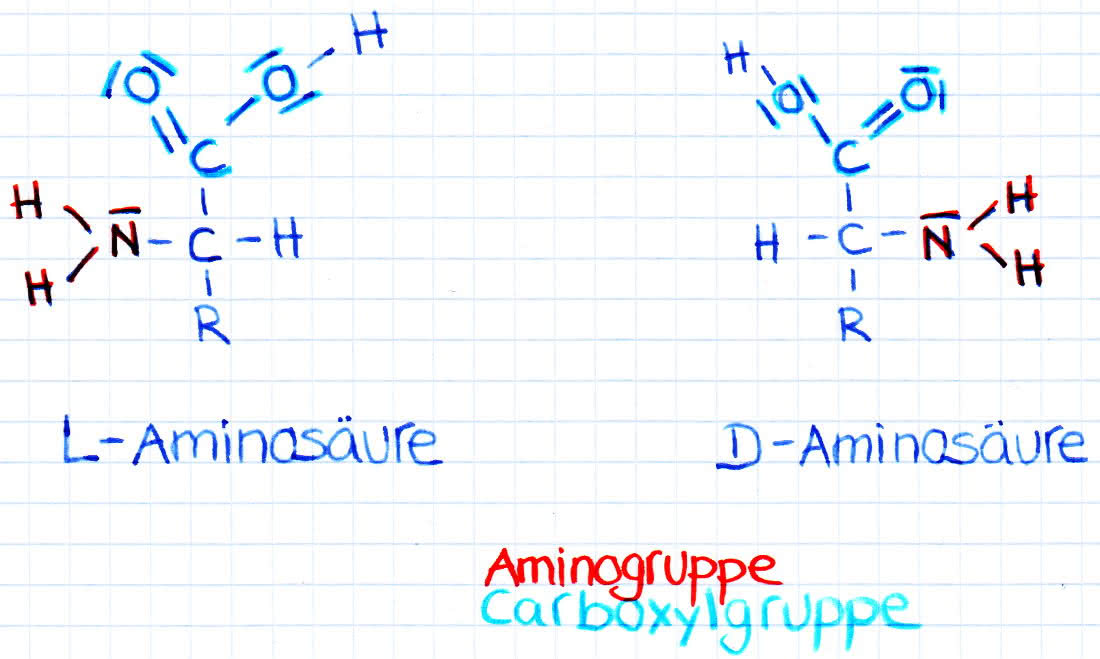
L- und D-Aminosäuren
Peptidbindung:
- zwei Aminosäuren können unter Wasserabspaltung zu einem Dipeptid kondensieren
- dabei reagiert die Aminogruppe der einen Aminosäure mit der Carboxylgruppe einer anderen Aminosäure
- und unter Abspaltung einer Wassermoleküls entsteht eine Peptidbindung
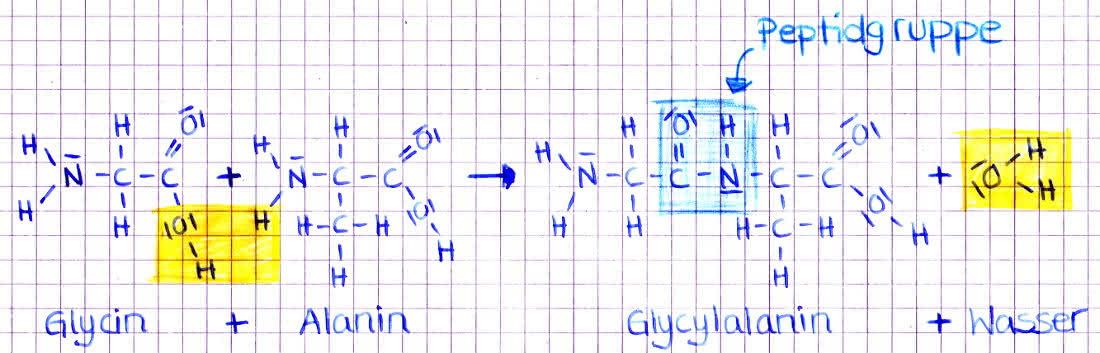
Peptidbindung Alanin und Glycin zur Bildung von Glycylalanin
