Namen: Lea Burhenne, Leonie Horst und 2013
Sarah Aschenbrücker, Daniel Garret 2014,
Salomee Blum und Nela Zupanic 2019-11
Geschichte von der Entdeckung und Verwendung von Aluminium:
- 1825 erstmals von Hans Christian Orsted hergestellt
=> Reaktion von Aluminiumchlorid mit Kaliumamalgam als Reduktionsmittel
- 1827: reineres Aluminium durch Verwendung von metallischem Kalium (Friedrich Wöhler)
=> Aluminium war teurer als Gold
- 1859: Veröffentlichung einer verfeinerten Herstellungsweise durch Henri Étienne Sainte-Claire Deville
=> größerer Gewinn -> Aluminiumpreis fiel um 90%
- 1886: Schmelzflusselektrolyseverfahren durch Hall und Héroult
- 1889: Carl Joseph Bayer -> Bayer-Verfahren
Namensgebung:
- vom lateinischen Wort "alumen" für Alaun
- zwei Namen in Gebrauch: Aluminium und Aluminum
Eigenschaften von Aluminium:
- Aggregatszustand (RT)=fest
- relativ weiches und zähes Leichtmetall
- chemisches Element mit Elementsymbol Al und Ordnungszahl 13
- dritte Hauptgruppe, 13. IUPAC-Gruppe (Borgruppe)
- stumpfes silbrig-weiches Leichtmetall
- das silbergraues Aussehen entsteht durch die stumpfe Oxidschicht, welche sich sich schnell an der Luft bildet
- sehr unedel, trotzdem oberflächliche Reaktion wegen Passivierung mit Luft und Wasser
Physikalische Eigenschaften von Aluminium:
- Atommasse: 26,9815u
- Aggregatzustand: fest
- Dichte (gering): 2,7 g/cm3 => Aluminium ist ein Leichtmetall
- Magnetismus: paramagnetisch
- Schmelzpunkt: 660,32°C, Siedepunkt: 2470°C
- relativ weiches Metall => sehr gut verformbar und dehnbar
- Elektronegativität von 1,61
- Molekülmasse von 27 u
Chemische Eigenschaften von Aluminium:
- reines Leichtmetall bildet an Luft/mit Sauerstoff sehr schnell dünne Oxidschicht => stumpfes, silbergraues Aussehen
- sehr guter Korrosionsschutz => kann nicht rosten
- einzigartige Eigenschaften => vielseitig einsetzbares Material
- 100 % recyclingfähig ohne Qualitätseinbußen
- Formschönheit, mechanische Eigenschaften, Langlebigkeit und Wertigkeit des Werkstoffes
- nicht giftig, nicht brennbar
Vorkommen von Aluminium:
- dritthäufigstes Element der Erdkruste nach Sauerstoff und Silicium (-> 7,57 Gewichtsprozent)
- häufigstes Metall weltweit!
- fast ausschließlich in gebundener Form (meist als „Bauxit“, dem unreinen Aluminium-Erz) aufgrund seines unedlen Charakter
- größte Menge: chem. gebunden in Form von Alumosilikaten
Verwendung von Aluminium:
Verwendung als Konstruktionswerkstoff:
- Bauen von Transportmitteln (vor allem in Luft- und Raumfahrt)
- Heizelementen (z.B.: Bügeleisen und Kaffeemaschinen)
- früher auch in Fassaden und Dachelementen
=> nur interessant, wenn Gewicht eine höhere Relevanz hat als Kosten
Verwendung als Legierung:
- Herstellung von Motoren und Getriebegehäuse
(=> Aluminiumgusslegierung)
Verwendung in der Elektrotechnik:
- Überlandleitungen
- aufgrund schlechter Kontaktierung schlecht für die Stromverbindung
=> Kupfer besser geeignet
Verwendung in der Elektronik:
- Antennen und Hohlleiter
- Elektrodenmaterial
=> gute elektrische Leitfähigkeit
Verwendung für Verpackung und Behälter:
- Konservendosen, Alufolie
- Kochtöpfe und andere Küchengeräte
In jedem Haushalt zu finden: Alufolie (sehr fein gewalztes Aluminium)
Verwendung in der Optik und Lichttechnik:
- Spiegelbeschichtung in Scannern, Kraftfahrzeug-Scheinwerfern, Spiegelreflexkameras
weitere Anwendungen und Verwendung von Aluminium:
- Treibstoff einer Rakete
- Feuerwerksraketen
- Aluminieren von Stoffen -> Sie werden formbarer, weniger spröde und zunderbeständig
Produktion von Aluminium
- Primäraluminium =>Herstellung aus Mineralien
- Sekundäraluminium =>Herstellung durch Recycling
- Hauptproduktionsländer: Australien, China, Guinea, Indien, Jamaika
Gewinnung von Aluminium in drei Schritten:
1. Aufbereitung des Bauxits
- für Wirtschaftszwecke lediglich Gewinnung aus Bauxit: Bestandteile: - ca. 60% Aluminiumhydroxid
- ca. 30% Eisenoxid
- Siliciumverbindungen, Verunreinigungen
- Trennung des Bauxits von Begleitstoffen
2. Bayer-Verfahren zur Herstellung von reinem Aluminium:
-> Aufschluss mit Natronlauge: mit Natronlauge bei Erhitzung auf - 150 – 200 °C unter Druck setzen
-> Aluminiumhydroxid liegt jetzt als Aluminat-Ion in Lösung vor
- Eisenoxid wird abgefiltert
- Verdünnung und Abkühlung der Aluminat-Lösung
- es entsteht erneut nicht lösliches Aluminiumhydroxid
- Trennung aus der Natronlauge (diese wird wiederverwendet)
- Erhitzen des Aluminiumhydroxids auf 1200 °C
- es liegt nur noch sehr reines Aluminiumoxid vor (Rohstoff, der zur eigentlichen Gewinnung von Aluminium dient)
-> Schmelzflusselektrolyse zur Umformung in reines Aluminium
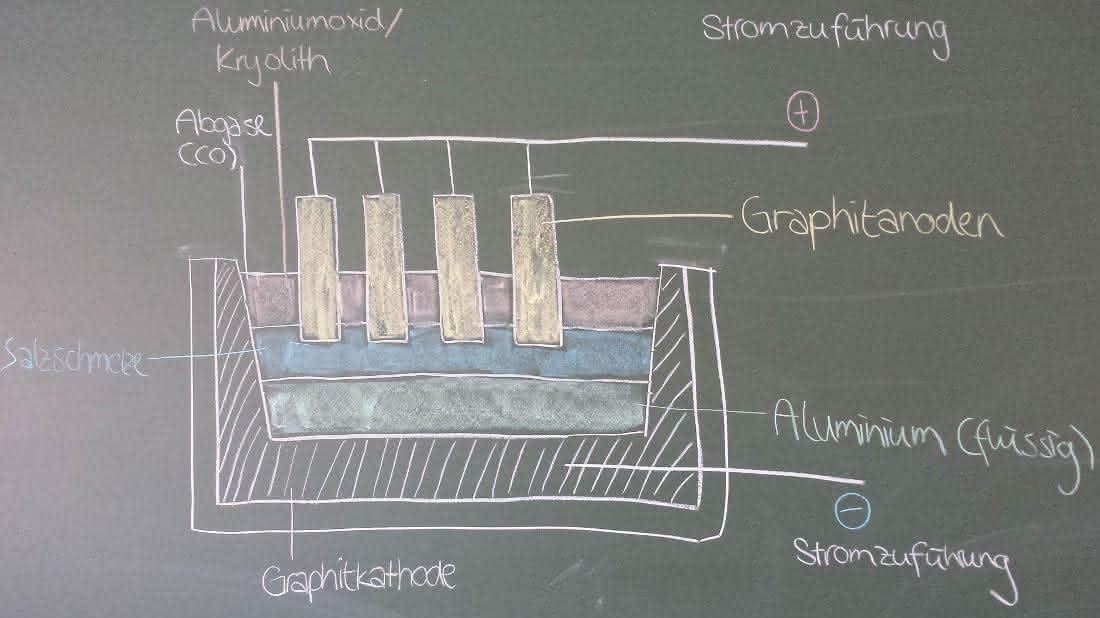
3. Schmelzflusselektrolyse (Hault-Heroult-Verfahren)
- Elektrolyseverfahren, wobei eine Elektrolyse von heißem geschmolzenem Salz durchgeführt wird
- Elektrolyse findet in gemauertem Elektrolyseofen statt
-> ist in mehrere Wannen eingesenkt, die innen mit Graphit beschichtet sind (mehrere Quadratmeter groß)
-> diese sind mit Aluminiumoxid gefüllt, welches mit der 10- bis 20-fachen Konzentration Kryolith angereichert ist
-> Kryolith dient zur Herabsetzung der Schmelztemperatur auf 950°C
(die Schmelzelektrolyse wäre sonst zu teuer -> Krytolith wird hinzugegeben => dadurch sinkt der Schmelzpunkt auf ca. 950°C)
- Elektrolyse wird bei einer Spannung von 4 bis 5 V und einer Stromstärke von 250.000 A durchgeführt
- von oben werden Kohleelektroden in die Schmelze eingeführt
-> dienen als Anoden
-> Oxid-Ionen werden an ihnen zu Sauerstoff oxidiert, welcher unter hoher Temperatur direkt mit den Elektroden reagiert -> Kohlenstoffmonooxid und Kohlenstoffdioxid
- Absaugen dieser Gase
-> verlassen die Aluminiumhütte über einen Schornstein
- Kohleelektroden nutzen sich mit der Zeit ab -> werden deshalb durchgängig von oben nachgeführt
-> werden bei völliger Abnutzung erneuert
- Ofen ist an der Unterseite mit Graphit ausgekleidet -> Kathode
-> Reduzierung der Aluminium-Ionen zu Aluminiumatomen
-> gewonnenes Aluminium sammelt sich am Boden der Schmelzflusselektrolysezelle, die Elektrolyt-Schmelze bleibt darüber
-Fremdstoffe lösen sich in Warmhalteöfen =>Aluminium mit einer Reinheit von ca. 99,5 – 99,9%
-> es wird mehrmals am Tag abgestochen
- die Schmelzflusselektrolyse hat sehr hohen Energiebedarf
-> ca. 14 kWh pro 1kg produziertem Aluminium
-> die elektrische Energie bestimmt den Preis des Aluminiums
-> Recycling von Aluminium gewinnt an Bedeutung, weil die Energiepreise steigen
-> momentan liefert das Recycling 20% der Weltproduktion von Aluminium
-> Recycling spart gegenüber der Gewinnung aus Bauxit bis zu etwa 95% der Energie ein
Zusammenfassung Schmelzelektrolyse
-Bauxit mit heißer Natronlauge unter Druck erhitzt: -Al2O3H2O+2H2O+NaOH ---> NaAl(OH)4
-Rotschlamm wird abfiltriert
-zurückbleibende Lösung wird verdünnt, damit Aluminiumhydroxid ausfällt
Verwendung von Aluminium:
-Preis: ~ 1500-2000€ / t
-Findet wegen der geringen Dichte oft in Luft- und Raumfahrt verwendung
-hauptsächlich Verkehr (Autoteile, ...)
-in der Elektronik weil:
-> guter Leiter
-> billiger als Kupfer
-> leicht zu verarbeiten
-> sehr leichtes Metall
Neues Verfahren zur Aluminiumgewinnung
=> das Elysis Verfahren (2015) soll ohne Graphitelektroden auskommen, so die Emissionen an CO2 senken. Nicht berücksichtigt wird dabei allerdings der nach wie vor hohe Bedarf an elektrischen Strom.
- neue und umweltfreundlichere Produktionsmöglichkeit von Aluminium
- bei der Produktion=> Freisetzung von Sauerstoff statt Treibhausgasen wie bei der Schmelzflusselektrolyse
- Apple als Kooperationspartner, da Apple großen Bedarf an Aluminium bei der Produktion von Geräten hat
- soll bis 2024 marktreif sein.
