Name: Leonie G. 2015
Raphael Kress, 2018-01
Salpetersäure: HN0₃ - Herstellung aus Nichtmetalloxiden:
Technische Herstellung (Ostwaldverfahren):
- im Jahr 1901 von Wilhelm Ostwald erfunden
- bis zu 1200 Tonnen können so tägl. in einer Anlage hergestellt werden
- Zur Herstellung gibt es drei Schritte:
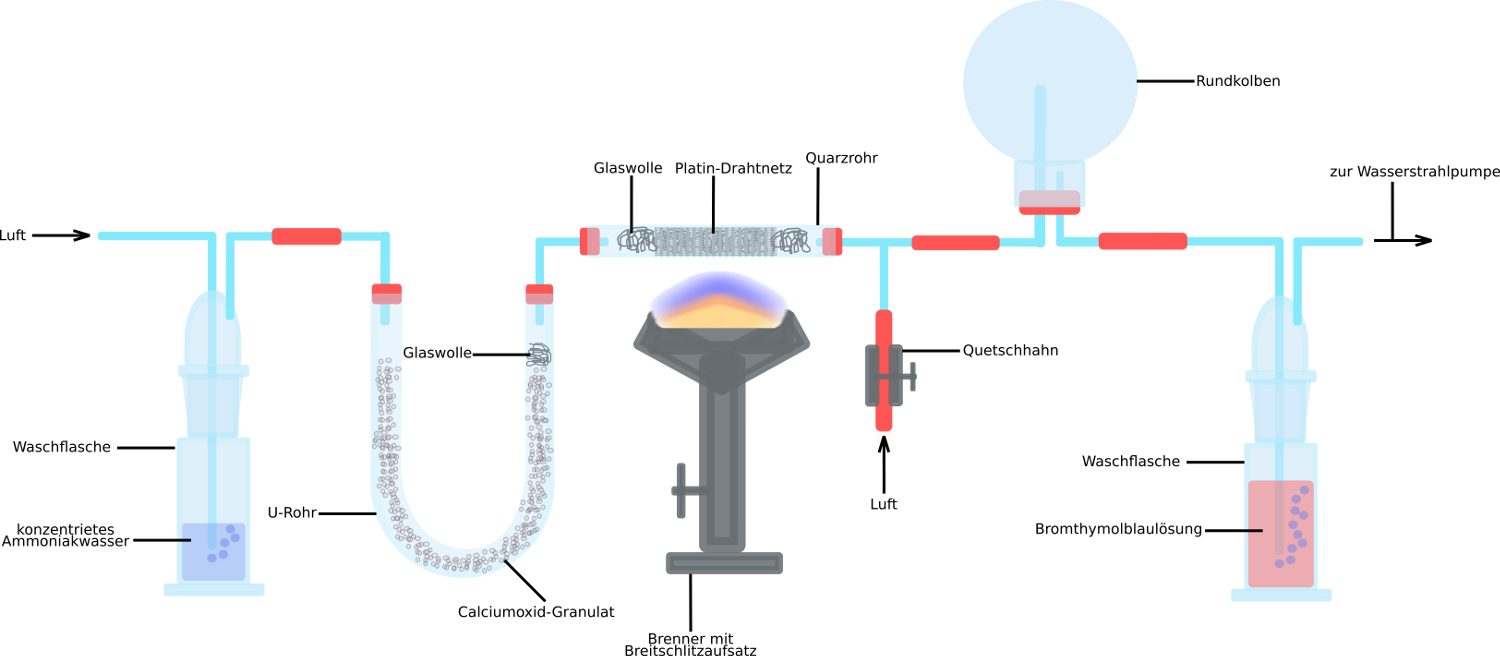
1. Sauerstoff + Ammoniak -> Stickstoffmonooxid + Wasser
2. Sauerstoff + Stickstoffmonooxid -> Stickstoffdioxid
3. Wasser + Stickstoffdioxid -> Stickstoffmonooxid + Salpetersäure
Salpetersäureherstellung nach dem Ostwaldverfahren - Klicke auf die Grafik zum Vergrößern
Eigenschaften von Salpetersäure:
- in reinem Zustand eine farblose bis gelbliche Flüssigkeit
- riecht stechend
- wirkt stark oxidierend und ätzend
Verwendung von Salpetersäure:
- als Düngemittel und Explosivstoffe
- als Salz in der Fotoindustrie
- zum Vergolden und als Nachweis von Gold
- zur Herstellung von Farbstoffen, Heilmitteln und Desinfektionsmitteln
- zum Polieren von Metallen
Salze der Salpetersäure:
- Nitrate sind in erster Linie Salze und Ester der Salpetersäure
- Salpetersäure + Metall -> Nitrat
- Bsp.: Silbernitrat, Magnesiumnitrat, Natriumnitrat, Kupfernitrat, Aluminiumnitrat
Eigenschaften der Nitrate:
- unter Lichteinfall leichte Zersetzung
- lösen sich gut im Wasser
- sind gute Oxidationsmittel (um Sauerstoff herzustellen)
Gefahren durch Nitrate und Nitrite:
Nitrat ist fast in allem enthalten, was wir essen und trinken. In bestimmten Mengen ist es gut für unsern Körper. Leider nehmen wir viel zu viel davon auf.
Die Folgen sind:
bei Nitraten:
- krebserregend
bei Nitriten:
- Ablagerungen verursachen Durchblutungsstörungen
- Nitrosaminen erregen Krebs (Nitrit + spez. Aminen)
- Behinderung der Sauerstoffaufnahme (durch Nitritanionen) - vor allem für Säuglinge gefährlich
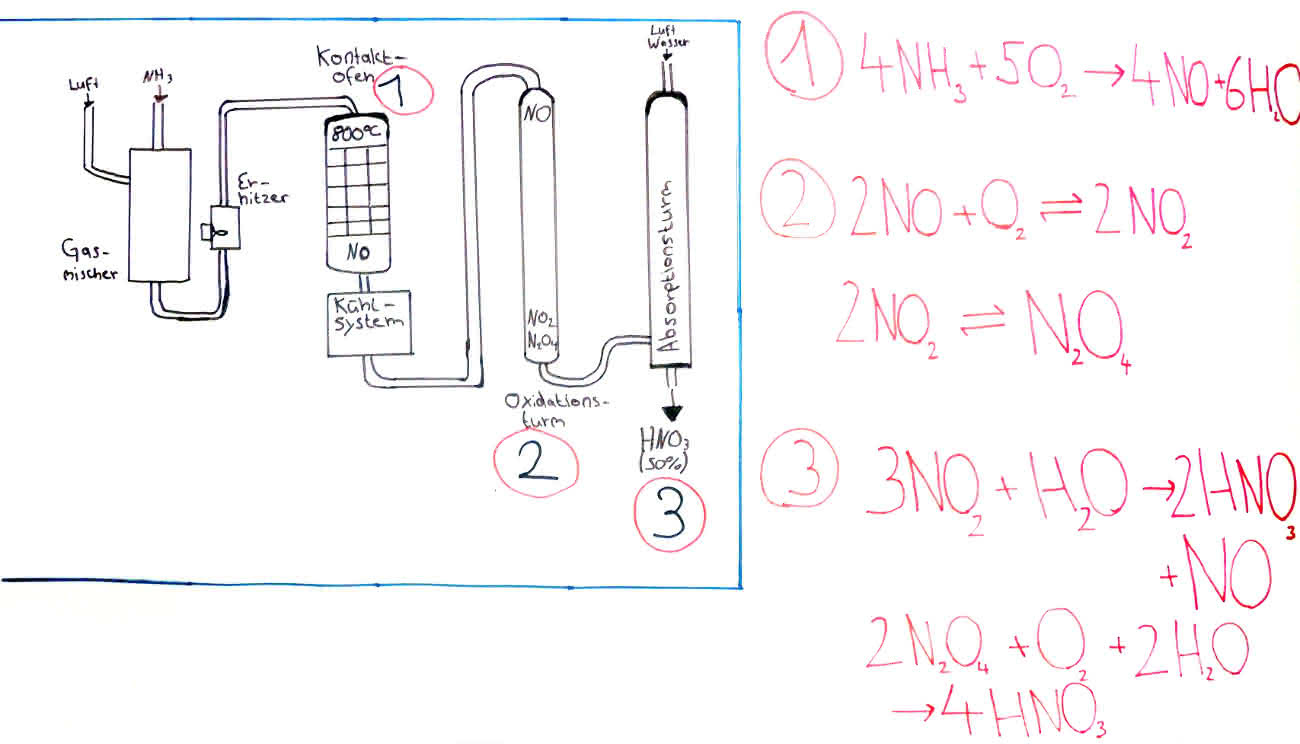
Salpetersäureherstellung nach dem Ostwald-Verfahren