Name: Valentin Rech, 2018-01
Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
In einer chemischen Reaktion werden aus den Ausgangsstoffen (Edukten) Produkte gebildet. Die Reaktionsgeschwindigkeit gibt an, wie viele Edukte in einer bestimmten Zeit zu Produkten umgesetzt werden. Zur Messung der Geschwindigkeit kann man die Massen-, Volumen- oder Konzentrationsänderung eines beteiligten Stoffs messen.
Die durchschnittliche Reaktionsgeschwindigkeit in einem bestimmten Zeitintervall lässt sich mittels der Konzentration mit der Formel
c(t2)-c(t1) Δc
v= ––––––––––– bzw. v= –––
(t2-t1) Δt
berechnen. Wird eine Abnahme eines Edukts gemessen, so ist lässt sich die Reaktionsgeschwindigkeit mit
Δc
v= - ––––
Δt
berechnen, da die Durchschnittsgeschwindigkeit sonst negativ wäre.
Dabei wählt man für die Konzentration c ein Reaktionsprodukt, das sich leicht messen lässt. Für "t1" bzw. "c(t1)" setzt man dazu den zeitlichen Startwert bzw. die Konzentration an diesem Zeitpunkt in die Formel ein. Dementsprechend stehen t2 bzw. c(t2) für den Endpunkt bzw. die Endkonzentration. Die daraus ermittelte Reaktionsgeschwindigkeit ist ein Mittelwert, der vom zeitlichen Intervall abhängt und ist nicht mit der Momentangeschwindigkeit zu verwechseln.
Da die Konzentrationsmessung in realen Versuchen kaum möglich ist, misst man die leichter ermittelbare Volumensänderung eines entstehen Produktes, die von der Konzentrationsänderung abhängt.
ΔV
v= ––––
Δt
Versuchsaufbau:
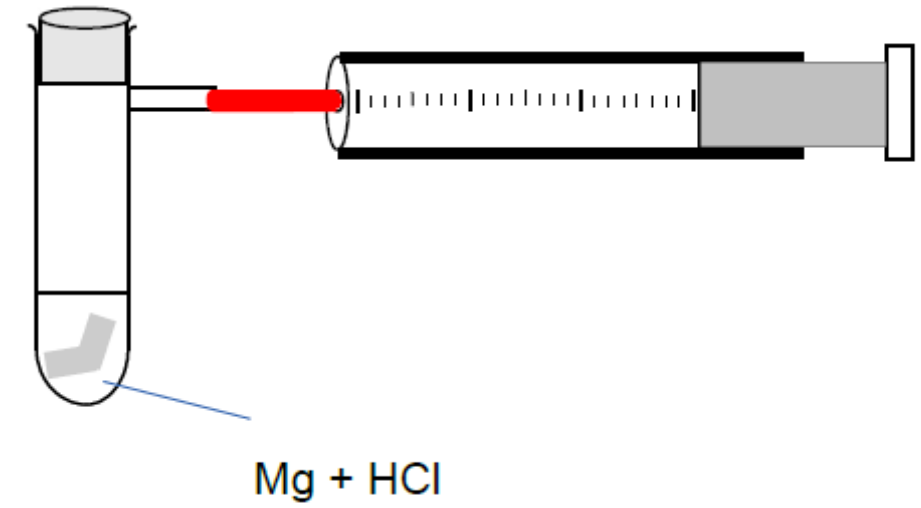
Das Bild zeigt einen beispielhaften Versuchsaufbau zur Messung der Reaktionsgeschwindigkeit bei der Reaktion von Magnesium (Mg) und Salzsäure (HCl) zu Wasserstoff (H2) Magnesiumionen (Mg2+) und Chloridionen (Cl-). Hierbei wird die Volumensänderung vom entstehenden Gas, Wasserstoff, mit einem Kolbenprober gemessen. Notiert man ab dem Reaktionsbeginn die Volumina zu verschiedenen Zeitpunkten, lässt sich ein Volumen/Zeit - Diagramm darstellen, das im Beispielversuch vereinfacht wie folgt aussieht:

Die Reaktionsgeschwindigkeit lässt sich nun mit der Steigung des Graphen bestimmen (Tipp: Steigungsdreieck einzeichen). Man sucht sich dazu einen Zeitintervall von zwei Punkten auf dem Graphen aus und setzt die abgelesen Werte in die Formel ein (natürlich kann man die Werte auch direkt aus der beim Versuch aufgestellten Tabelle entnehmen). Steigt der Graph stark an wird viel Gasvolumen in einer kurzen Zeit produziert , es liegt also eine hohe Reaktionsgeschwindigkeit vor. Auffällig ist, dass die Reaktionsgeschwindigkeit nicht konstant bleibt und der Graph sich der einer waagerechten Grenze annähert. Verläuft der Graph waagerecht, dann vergeht Zeit, ohne ,dass das Gasvolumen steigt. Die Reaktion ist also zum erliegen gekommen.
Das Bestimmung der Reaktionsgeschwindigkeit mit dem Volumen möglich ist, lässt sich durch die mathematische Abhängigkeit von Konzentration und Volumen verifizieren:
n
c= –––
V
Das Volumen eines entstehenden Produktes ist abhängig von dessen Stoffmenge (n).
Wichtig: Die Reaktionsgeschwindigkeit wird durch Faktoren wie Konzentration der beteiligten Stoffe, Druck, Temperatur, Katalysatoren und Zerteilungsgrad beeinflusst. Generell gilt dabei je höher die Konzentration und die Temperatur, je größer der Druck und der Zerteilungsgrad (die Oberfläche), desto schneller läuft die Reaktion ab.
Der Einfluss der Konzentration auf die Reaktionsgeschwindigkeit und deren Bestimmung
