Name: Joschua Möller, 2022-04
Farbigkeit und Molekülstruktur
Die Farbigkeit von organischen Molekülen hängt einerseits von der chemischen Struktur und andererseits von der Ausdehnung des π-Elektronensystems (Pi-Elektronmensystem) ab. Sie entsteht durch Lichtabsorption und Lichtemission durch das organische Molekül.
Voraussetzung für das Entstehen von Farbigkeit ist das Vorhandensein eines linearen oder zyklischen Systems mit einer ausreichenden Anzahl von konjugierten Doppelbindungen. In dem organischen Molekül müssen also alternierend Doppel- und Einfachbindungen vorhanden sein. Dieser Grundkörper des Farbstoffes wird auch Chromophor genannt.
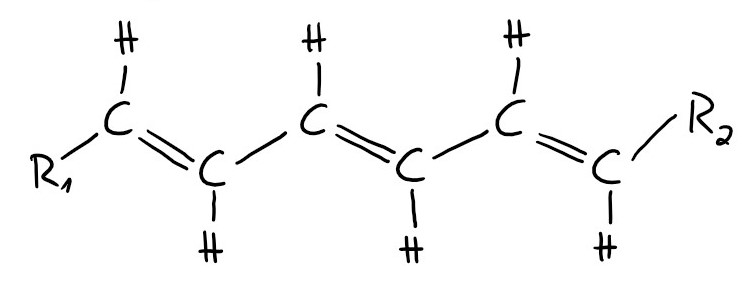
Ausschnitt aus einem Abschnitt mit konjugierten Doppelbindungen
Nehmen wir an, dass ein organisches Farbstoffmolekül aus Ketten mit jeweils acht Kohlenstoffatomen besteht, zwischen denen sich konjugierte Doppelbindungen befinden. Nun benötigt jedes dieser Kohlenstoffatome nur drei seiner vier Elektronen zur Bindung an seine drei nächsten Nachbarn. Das vierte Elektron gibt jedes Kohlenstoffatom an die ganze Kette ab. Es ist also über den ganzen Bereich des Stoffes verteilt. Diese delokalisierten Elektronen nennt man π-Elektronen (Pi-Elektronen). Da wir acht Kohlenstoffatome haben, besitzen wir nun auch acht π-Elektronen. Das Molekül kann man sich als linearen Potenzialtopf vorstellen. Das ist ein Topf, in dem nach dem Pauliprinzip, maximal zwei Elektronen in einem Energieniveau vorhanden sein können. Ein Energieniveau ist ein Zustand, in dem sich ein Elektron befindet und dabei eine bestimmte Energie besitzt. Es befinden sich also nun acht Π-Elektronen in dem Potenzialtopf, die sich auf vier Energieniveaus mit jeweils zwei Π-Elektronen verteilen.
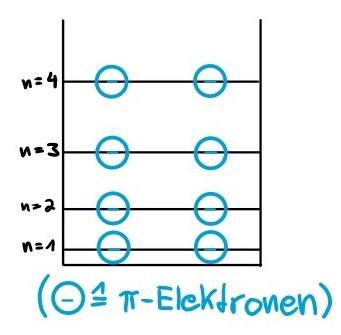
Trifft nun Licht der Sonne, mit sehr vielen Frequenzen, darunter allen Farben des sichtbaren Bereichs, auf das Molekül, absorbiert das Molekül genau die Energie (Farbe), die es benötigt um ein Π-Elektron vom vierten Energieniveau auf das fünfte Energieniveau anzuheben. Da dieser Zustand instabil ist, fällt das Π-Elektron wieder in das vierte Energieniveau zurück. Dabei wird Energie in Form von elektromagnetischer Strahlung (Licht) emittiert, welche genau die gleiche Energie (Farbe) besitzt, die das Molekül zuvor absorbiert hat. Da dies aber isotrop, also in alle Richtungen geschieht, fehlt diese Farbe dann im zuvor am Molekül reflektierten Licht, was sich aus den übrigen Farben des Lichts der Sonne zusammensetzt. Die übrigen Farben ergeben dann die Komplementärfarbe der absorbierten Farbe und wir sehen den Stoff in eben dieser Komplementärfarbe. Dieser Vorgang wird auch Resonanzabsorption genannt.

Die Länge des organischen Moleküls ist also entscheidend dafür, in welcher Farbe wir den Stoff sehen. Die Länge kann durch die Anzahl an konjugierten Doppelbindungen (Chromophor) und durch das Anhängen von Auxochromen an den Enden verändert werden. Auxochrome sind Substituenten mit einem + oder – I-Effekt, die mit dem Doppelbindungssystem des Chromophors in Mesomerie treten können. (z.B. OH, OR, CHO)
Merke: Licht regt die Elektronen eines Farbstoffes an. Dabei spielen vor allem die π-Elektronen (also die Doppelbindungen) eine große Rolle.Je ausgeprägter nun ein konjugiertes und delokaisiertes π-Elektronensystem ist, desto besser können Wellenlängen aus dem bekannten Lichtspektrum absorbiert werden.
Die anderen Anteile, also das nichtabsorbierte Licht, werden reflektiert und bestimmen dir für uns sichtbare Farbe.
Dabei gilt: Die sichtbare Farbe ist immer komplemetär zur absorbierten! Wird also rot absorbiert, erscheint uns der Stoff grün.
Der Abschnitt des Farbstoffs, der das Licht absorbiert wird auch Chromophor (griechisch: chroma = Farbe) genannt. Je umfangreicher der Chromophor ist, also, je ausgeprägter das π-Elektronensystem, desto eher kann Licht mit langen Wellenlänge (also kleinerer Frequenz -> in Richtung des roten Lichtes) absorbiert werden.
Beispiel:
Dies kann man anhand von einer Wiese im Sommer erklären. Wird eine Wiese genügend gewässert und gepflegt, besitzt sie eine starke grüne Farbe, da im inneren des Grases das π-Elektronensystem des Chlorophylls groß genug ist, um Licht der Wellenlänge zwischen ca. 605 nm und 750 nm (rot) zu absorbieren.
Dabei sehen wir das Gras in der Komplementärfarbe grün. Wird die Wiese aber nicht mehr gewässert und Sonne strahlt auf die Wiese, wird durch die hohe Energie der Sonnenstrahlen in Form von Wärme die Wiese allmählich farbloser und heller. Dies liegt daran, dass die konjugierten Doppelbindungen durch die Hitze aufgebrochen werden, wodurch das π-Elektronensystem kleiner wird.
Dadurch kann das Gras nur noch Licht der Wellenlänge zwischen ca. 400 nm und 440 nm absorbieren (violett) und wir sehen die Wiese in einer gelbgrünen Farbe.
Daran sieht man, je größer das π-Elektronensystem ist, desto farbiger erscheint uns ein Stoff.
