Name: Philipp Dietl, 2012
Fabian Müller, 2023-03
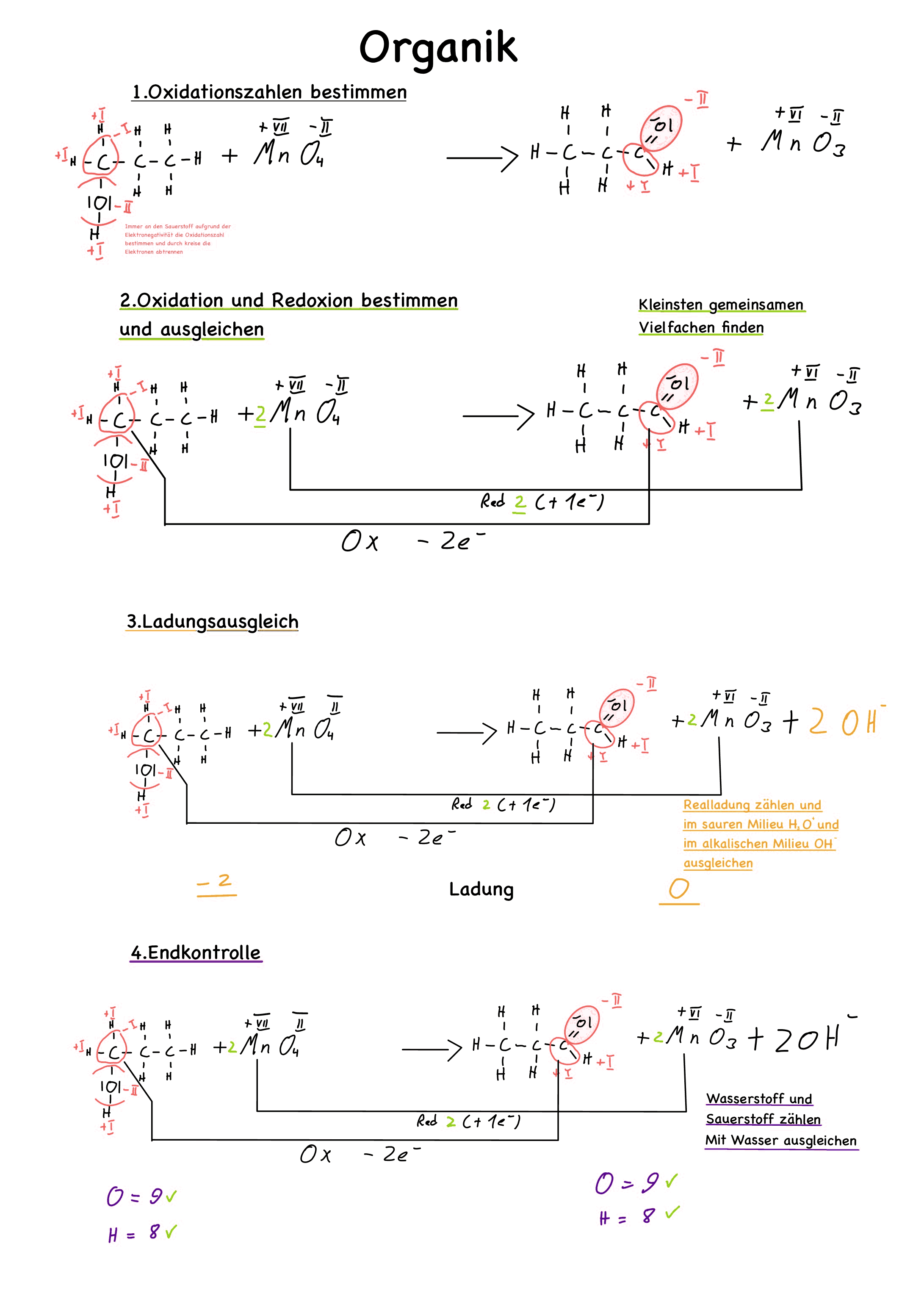
Grundsätzlich gibt es zwei Methoden, um komplexe Redoxreaktionen aufzustellen. Den vollständigen Weg oder die so genannte "Lasso"-Methode. Letztere geht unter Umständen etwas schneller. Diese Methode wird am Ende des Artikels erklärt.
1. Der vollständige Weg zum Erstellen von Redoxreaktionsgleichungen
Schritte zum Erstellen von Redoxgleichungen
1. Vorläufige Gleichung notieren ( in eckigen Klammern )
Man stellt Produkte und Edukte auf.
[Cu + HNO3 ---> NO2 + CuO ]
2. Oxidationszahlen ermitteln
Man bestimmt die Teilladungen aller Ionen und schreibt sie (mit Bleistift) oben drüber.
Cu: 0 ---> Cu: II Oxidation
H: -I ---> H: -I keine Reaktion
N: VI ---> N: IV Reduktion
O: -II ---> O: -II keine Reaktion
3. Teilgleichungen aufstellen
Red: HNO3 + e- ---> NO2
Ox: Cu ---> CuO + 2e-
4. Ladungsausgleich (mit H+/H3O+ und (OH)-)
Falls die Ladung auf der Linken Seite negativer ist als auf der Rechten Seite ergäntzt man entweder auf der Linken Seite H+/H3O+ oder auf der Rechten Seite (OH)-. Man ergäntz allerding nur soviele H+/H3O+/OH- wie unterschiedliche Ladung vorhanden ist. In alkalischer Lösung wird mit (OH)-(Hydroxidionen) und in in saurer Lösung durch H3O+/H+ (Oxioniumionen).
Red: HNO3 + e- + H+---> NO2
Ox: Cu ---> CuO + 2e- +2H+
5. Stoffausgleich mit Wasser
Nach dem man die Ladung ausgeglichen hat muss nun wieder der Stoffausgleich vorgenommen werden. Man gleicht mit H2O aus.
Red: HNO3 + e- + H+---> NO2 + H2O
Ox: Cu + H2O ---> CuO + 2e- +2H+
6. Elektronen Zahl durch Multiplikation untereinander ausgleichen
Man multipliziert beide, damit sie auf die selben Elektronenzahlen kommen.
Red: HNO3 + e- + H+---> NO2 + H2O |*2
Ox: Cu + H2O ---> CuO + 2e- +2H+ |*1
---------------------------------------------------------
Red: 2HNO3 + 2e- + 2H+---> 2NO2 + 2H2O
Ox: Cu + H2O ---> CuO + 2e- +2H+
7. Teilgleichungen addieren
Man addiert die beiden Teilgleichungen.
Red: 2HNO3 + 2e- + 2H+---> 2NO2 + 2H2O
Ox: Cu + H2O ---> CuO + 2e- +2H+
---------------------------------------------------------
Redox: 2HNO3 + 2e- + 2H+ + Cu + H2O ---> 2NO2 + 2H2O + CuO +2e- + 2H+
8. "Kürzen"
Man "kürzt" die Elektronen auf beiden Seiten. Falls vorhanden können auch Wassermoleküle und Wasserstoffionen gekürzt werden. Mathematisch ist es übrigens kein Kürzen, sondern eine Subtraktion.
Redox: 2HNO3 + Cu ---> 2NO2 + H2O + CuO
9. Bei Ionen wieder zu Salzen ergänzen
Falls die Ausgangsstoffen Verbindungen sind, in denen nur ein Teil von ihnen reagiert, so können diese Stoffe wieder in der Schluss Gleichung zusammengesetzt werden. Dieser Schritt ist allerdings nicht unbedingt notwendig.
10. Probe
Zum Schluss sollte man noch eine Probe machen. Man zählt die Ionen auf der Rechten Seite, den Edukten und auf der Linken Seiten, den Produkten.
H: 2/2
O: 6/6
N: 2/2
Cu: 1/1
Oxidation und Reduktion - Definitionen
Oxidation: Elektronenabgabe (Oxidationszahl wird größer )
Reduktionsmittel → Produkt + e-
Reduktion: Elektronenaufnahme ( Oxidationszahl wird kleiner)
Oxidationsmittel + e- → Produkt
2. Die "Lasso-Methode" zum Erstellen von Redoxreaktionen
Aufstellen von Redoxreaktionen nach der Lasso-Methode: Beispiel der anorganischen Chemie