Namen: Daniel P., Robert N., Denis N., Ferdinand W.
Datum 2012 // 2019-04
Proteine bestehen aus Ketten mehrerer miteinander verknüpfter Aminosäuren! Die Verknüpfung geschieht durch Peptidbindungen.
Die Bildung eines Polypeptids & Proteinstrukturen
Die Primärstruktur sind Aminosäuren entsteht durch Peptidbindungen, bei denen sich Aminosäure miteinander verbinden, wobei sich das Hydroxid-Ion der Carboxylgruppe einer Aminosäure mit dem Wasserstoff-Ion der Ammoniumgruppe einer anderen Aminosäure verbindet und Wasser entsteht. An dieses Polypeptid kann sich eine beliebige Anzahl an weiteren Aminosäuren binden und diese Anzahl der Aminosäuren entspricht der Anzahl an Wassermolekülen, die beim Verbinden entstehen.
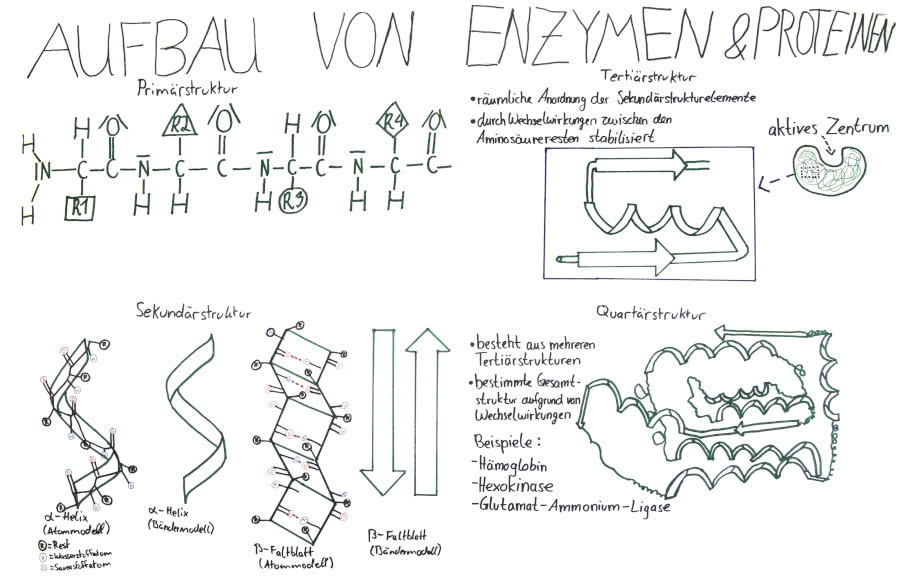
Aufbau von Enzymen (Klicken zum Vergrößern)
Proteine können in verschiedenen Strukturen vorliegen (Primärstruktur, Sekundärstruktur, Tertiärstruktur und Quartätstruktur). Ursache für diese Vielfalt ist die Faltung der reinen Primärkette (Primärstruktur) durch Innermolekulare Wechselwirkungen (Dipol-Dipol-Kräfte, Van-der-Waals Kräfte, Disulfidbrücken, Wasserstoffbrückenbindungen).
Die Primärstruktur nimmt durch Faltung eine bestimmte räumliche Struktur an, welche man Sekundärstruktur nennt. Wir kennen 2 verschiedene Faltungsarten: Die Alpha-Helix, welche im Bändermodell als Helix und das Beta-Faltblatt, welches als Pfeil dargestellt wird.
Die Tertiärstruktur wird die räumliche Anordnung der Sekundarstrukturen genannt. Wechselwirkungen, wie Wasserstoffbrückenbindungen zwischen unpolaren Resten und VAN-DER-WAALS-Wechselwirkungen zwischen polaren Resten, dienen der Stabilität der Tertiärstruktur.
Außerdem entwickeln sich Disulfidbrücken und Ionenbindungen.
Bei einem Protein mit mehreren Untereinheiten, liegt eine Quartärstruktur vor, die durch Wechselwirkungen eine bestimmte Gesamtstruktur einnimmt. Beispiele für eine Quartärstruktur sind: Hämoglobin, Myoglobin und Kollagen.
Merke: Eine regelmäßige Faltung bildet dabei die Sekundärstruktur aus. Liegen mehrere davon vor, nennt man es Tertiärstruktur. Eine Quartärstruktur ist eine Kombination verschiedener Aminosäureketten in ihren Tertiärstrukturen.
Allgemeines zu Proteinen (Eiweiße)
Proteine, auch genannt Eiweiße, sind Makromoleküle, die aus Aminosäuren aufgebaut sind. Sie geben den Zellen ihre Struktur, transportieren Reaktionsprodukte und pumpen Ionen.
Das Wort für „Protein“ kommt aus dem Griechischen (=proteios) und bedeutet so viel wie vorrangig (protos= Vorrangiger). Gerardus Johannes Mulder benutzte diese Bezeichnung erstmal in einer Veröffentlichung im Jahr 1839.
Alle Proteine eines Lebewesen (auch Gewebe, Zelle, Zellkompartiment) zusammen werden als Proteom bezeichnet.
Bildung der Proteine in der Proteinbiosynthese
Die Bausteine eines Proteins, die sogenannten Aminosäuren, bilden ab 100 aneinanderhängenden Teilen Peptide, die wiederum miteinander zu Ketten verbunden werden. Von einem Protein wird erst ab einer größeren Kettenlänge gesprochen, da sie eine bestimmte Größe benötigen, um sich für Enzymreaktionen zu eignen. Um Mutationen, die meist größere Proteine betreffen, vorzubeugen, besitzen die Meisten jedoch unter 1000 Aminosäuren.
Die Masse des Proteins wird in Kilo-Dalton (kDa) angegeben. Das größte bekannte ist das Muskelprotein Titin, welches aus über 30000 Aminosäuren besteht.
Im menschlichen Organismus werden 21 verschiedene Aminosäuren gebildet, davon sind 8 essentiell bzw. der Körper kann sie nicht selbst herstellen.
Der Aufbau eines Proteins, die Aminosäuresequenz, ist in der Desoxyribonukleinsäure (DNA) codiert. Dazu wird ein genetischer Code verwendet, der sich durch die Evolution bisher kaum veränderte.
Ribosomen nutzen die auf der DNA sitzenden Informationen, um neue Proteine zusammenzusetzen. Die Reihenfolge der Aminosäuren ist dabei strikt vorgegeben.
Das humane Genom enthält ca. 20.300 Proteine, weniger, als vor der Sequenzierung des Genoms angenommen. Insgesamt codieren nur etwa 1,5 % der gesamten genomischen DNA für Proteine, wobei der Rest aus Genen für non-coding RNA, Introns, regulatorischer DNA und nichtcodierende DNS besteht.
Räumlicher Aufbau von Proteinen
Die Proteinstruktur lässt sich in vier Arten einteilen:
Primärstruktur
Als Primärstruktur wird die Abfolge der Aminosäuren einer Polypeptidkette bezeichnet. (A1, A2, A3…). Somit beschreibt die Struktur jedoch nur die Aminosäuresequenz und nicht den räumlichen Aufbau.
Sekundärstruktur
Bei der Sekundärstruktur wird zwischen α-Helix und β-Faltblatt unterschieden. Diese bezeichnen häufig auftretende Motive für die räumliche Anordnung der Aminosäure und ergeben sich durch Wasserstoffbrückenbindungen zwischen den Peptidbindungen.
Tertiärstruktur
Die Tertiärstruktur ist die der Sekundärstruktur übergeordnete räumliche Anordnung der Polypeptidkette.
Auftretende Bindungskräfte sind Disulfidbrücken (kovalente Bindungen) sowie nicht kovalente Bindungen (Wasserstoffbrücken). Zudem treten Van-der-Waals-Kräfte auf, durch die sich das Protein weiter faltet.
Quartärstruktur
Mehrere Tertiärsturkturen bilden zusammen einen Proteinkomplex, der entweder aus mehreren Polypeptidketten oder einer Zusammenlagerung mehrerer Proteine entstehen kann. Die Untereinheiten eines solchen Komplexes werden Protomere genannt und die meisten sind nur im Komplex funktionsfähig. Des Weiteren werden dahingehend zwei Hauptgruppen von Proteinen unterschieden
Globuläre Proteine sind kugel oder birnenähnlich geformt und sind meist in Wasser oder Salzlösungen gut lösbar. Fibrilläre Proteine besitzen eine fadenförmige oder faserige Struktur und sind meist unlöslich, da sie zu den Stütz- und Gerüstsubstanzen zählen (Keratine in den Haaren z.B.).
Funktionen der Proteine im Organismus:
Proteine sind zu einem großen Teil als Enzyme im Körper tätig

Enzymatische Funktion von Proteinen (Klicken zum Vergrößern)
-
Schutz, Verteidigung gegen Mikroorganismen
-
Körperstruktur, Bewegung
-
Kollagene sind Strukturproteine der Haut, des Bindegewebes und der Knochen
-
Strukturproteine -> Aufbau des Gewebes bzw. des gesamten Körperbaus
-
-
Muskeln -> Myosine und Aktine, die die Muskelkontraktion befähigen, verändern ihre Form
-
Keratinstukturen -> Haare/Wolle, Nägel/Klauen, Schnäbel
-
Stoffumsatz (Metabolismus)
-
Enzyme -> ermöglichen und kontrollieren (bio)chemische Reaktionen
-
Regulation der Ionenkonzentration
-
Transportproteine -> Transport von Hämoglobin, Transferrin
-
Membranrezeptoren ermöglichen Konformationsänderungen
-
kleinere Proteine steuern als Hormone Vorgänge im Körper
-
Blutgerinnnungsfaktoren -> verhindern Blutverlust bei Verletzungen
-
Reservestoff
-
-
Proteine als Energielieferant im Hungerzustand
Mutationen bedingen Änderungen im Aufbau des Proteins:
-
Verlust der Proteinfunktion -> erhebliche Krankheiten
-
Erhöhung der Enzymaktivität
-
Funktion bleibt erhalten -> stille Mutation
-
vorteilhafte, funktionelle Veränderung
Denaturierung von Proteinen
Die Struktur eines Proteins kann sich unter Einfluss von Druck, Temperaturen ab ca. 45°C und physikalischen Einflüssen verändern, sodass die räumliche Struktur des Proteins zerstört wird. Dieser Vorgang kann meist nicht umgekehrt , d.h. der ursprüngliche dreidimensionale Aufbau nicht wiederhergestellt, werden.
So kann sich z.B. das feste Eiklar nach dem Kochen nicht wieder verflüssigen.
Auch bei einer Proteinoxidation durch reaktive Sauerstoffspezies (Sauerstoffradikale) kann bei Proteinen zu einem Funktionsverlust und zur Ansammlung von degenerierten Proteinen in der Zelle führen.
Die Denaturierung spielt eine Rolle bei der Nahrungszubereitung, vor allem von Fisch und Fleisch:
Menschen denaturieren durch Kochen ihre Nahrung, um sie leichter verdauen zu können. Bei Fieber denaturieren bereits einige Proteine (Enzyme), die dadurch ihre überlebenswichtigen Funktionen verlieren.
Wirtschaftliche Bedeutung der Proteine
- In Deutschland werden im Jahr rund 55000 Tonnen Eiweiße verwendet. Diese sind meist tierischer Herkunft. Ein Großteil der pflanzlichen Proteine werden für die Futtermittelindustrie verbraucht.
- Im Bezug zu den tierischen Proteinen ist die Gelatine zu nennen, die aus Rinder- und Schweineknochen gewonnen wird und dessen Produktion etwa 32000 Tonnen pro Jahr beträgt. Circa die Hälfte davon wird in der chemischen sowie pharmazeutischen Industrie verwendet.
- Auch Casein stellt neben der Gelatine eine wichtige Proteinquelle, vor allem für die Chemieindustrie, dar, da das aus Milcheiweiß gewonnene Protein vor allem für Glanzpapiere als Beschichtung dient.
- Weitere 6000 bis 7000 t Proteine sind Produkte aus Hefen, die vor allem Anwendung in pharmazeutischen Belangen finden.
Proteinhaltige Nahrungsmittel:
-
Fleisch
-
Fisch
-
Eier
-
Milchprodukte (Käse und Quark)
-
Nüsse
-
Hülsenfrüchte (Soja: 41,5 %)
Proteinmangel
Da Proteine (Eiweiße) viele Aufgaben im menschlichen Körper besitzen, darunter die Erhaltung der Körperzellen und die Heilung von Wunden und Krankheiten, wirkt sich ein Proteinmangel negativ auf die Gesundheit aus. Ein Erwachsener sollte 0,8 Gramm Protein pro Kilogramm Körpergewicht zu sich nehmen. Der Bedarf ist bei Kindern und Schwangeren erhöht, körperliche Aktivität steigert ihn jedoch nicht. Die essenziellen Aminosäuren müssen über die Nahrung aufgenommen werden. (Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Thryptophan, Valin).
Ein Mangel kann folgende Symptome hervorrufen:
-
schlimmster Fall: Eiweißmangelkrankheit (Kwashiokor)
-
Hungerbauch (Einlagerungen von Wasser)
-
Muskelschwäche
-
Wachstumsstörungen
-
Fettleber
-
Haarausfall
-
Andauernder Eiweißmangel kann bis zum Tod führen
-

