Name:
David J., Johannis K., 2014
Marius Lindenthal, 2017-01
Benedikt Heil 2021-01
Einflüsse von Molekülmasse, Wechselwirkungen auf Schmelz- und Siedepunkt
Der Siedepunkt bzw. der Schmelzpunkt wird von zwischenmolekularen Kräften und der Molekülmasse beeinflusst.
Siedepunkt und Schmelzpunkt sind die Punkte, an dem ein Stoff den Aggregatzustand wechselt.
(Siedepunkt: flüssig zu gasförmig / Schmelzpunkt: fest zu flüssig).
Hierbei spielt die Eigenbewegung der einzelnen Moleküle eine wichtige Rolle, wie sie im nächsten Abschnitt erklärt wird.
Schmelz- und Siedepunkt sind von unterschiedlichen Faktoren abhängig. Ein großer Faktor sind dabei die sogenannten intermolekularen Wechselwirkungen, also Kräfte zwischen Molekülen. Diese Wechselwirkungen sind weiter zu untergliedern: Wesentlich sind hier Wasserstoffbrückenbindungen, polare Atombindungen mit damit verbundenen elektrostatischen Wechselwirkungen und Van-der-Waals-Kräfte.
Bei einem festen Stoff sind die Moleküle "gitterförmig", mit einer bestimmten Eigenbewegung, miteinander verbunden. Wird diesem Stoff Energie zugeführt, schwingen die Moleküle schneller, der Stoff erwärmt sich. Wird weiterhin Energie hinzugefügt, schwingen die Moleküle irgendwann so schnell, dass der Verband auseinander bricht und der Stoff den Aggregatzustand vom festen ins flüssigen Aggregatzustand wechselt (Schmelzpunkt).
Fügt man nun weiterhin Energie zu, schwingen die Moleküle nach einer gewissen Zeit so schnell, dass sie den flüssigen Verbund verlassen und in den gasförmigen wechseln. Hier ist die Eigenbewegung der Moleküle regellos, und zwischenmolekulare Kräfte existieren nicht mehr, da der Abstand der Moleküle zu groß ist.
Die Temperatur, bei der ein Stoff den Aggregatzustand wechselt, ist zum einen vom Molekulargewicht und zum anderen von zwischenmolekularen Kräften abhängig.
1. Einfluss der Molekülmasse:
Wärme entspricht der Bewegung der Teilchen. Je größer die Masse eines Teilchens, desto mehr Energie braucht man, um es in Bewegung zu setzten.
Beispiel: Vergleich zwischen Chlor und Sauerstoff
Je schwerer ein Molekül ist, desto mehr Energie benötigt man um es in Schwingung zu setzen. Demnach muss auch der Siede/- und Schmelzpunkt höher liegen.
Beispiel : Chlor Sauerstoff
Masse : 35,45u 15,99u
Schmelztemperatur: -101,5°C -218,3
Siedetemperatur : -34,6°C -183°C
2. Einfluss der Wechselwirkungen
2.1 Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen treten in der organischen Chemie vor allem in den Gruppen der Alkohole, Adehyde, Carbonsäuren und der Amine auf.
(Bild)
Wasserstoffbrückenbindungen kommen dort zustande, Stickstoff, Sauerstoff oder Fluor (N,O, F) in Molekülen Bindungen mit Wasserstoff im Nachbarmolekül eingeht. Die positiven Wasserstoffe und das freie Elektronenpaar eines anderen Moleküls (z. B. Sauerstoff) ziehen sich hierbei aufgrund ihrer Ladungen gegenseitig an.
Tatsächlich sind diese Wechselwirkungen sehr stark und damit maßgeblich entscheidend für die Schmelz- und Siedetemperatur eines Moleküls.
Je mehr WBBs also ausgeprägt sind, desto höher sind Schmelz- und Siedepunkt anzusiedeln.
Beispiele:
H3C-CH2-OH
Das Sauerstoffatom besitzt die Elektronegativitätszahl 3,44, während das Wasserstoffatom die Elektronegativitätszahl 2,2 besitzt. Die Elektronegativitätsdifferenz dieser Bindung beträgt also ΔEN=1,24. Daher "zieht" das Sauerstoffatom das Binungselektron eher zu sich und ist deshalb negativ geladen, während das Wasserstoffatom logischerweise positiv geladen ist. Aufgrund dieser auftretenden Wechselwirkungen ziehen sich die Moleküle untereinander an. Bei der Gruppe der Alkohole wirken also sowohl Van-Der-Waalskräfte, als auch Wasserstoffbrückenbindungen, was dafür sorgt, dass der Siede/- und Schmelzpunkt höher als bei Alkanen der vergleichbaren Masse liegt.
Beispiel: Propan Propan(-1-)-ol
Schmelztemperatur: -187°C -126°C
Siedetemperatur : -42°C 97°C
2.2 Elektrostatische Wechselwirkungen - Dipol-Dipol-Kräfte
Voraussetzung für das Vorkommen von elektrostatischen Wechselwirkungen ist mindestens eine polare Atombindung. Daraus resultieren nämlich polare Anziehungskräfte, die zum Erreichen eines neuen Aggregatszustands überwunden werden müssen.
Da diese Art der Wechselwirkung, insofern sie auftreten kann, dauerhaft vorliegt, ist sie gerade bei kleineren Molekülen ein beachtlicher Faktor im Bezug auf Schmelz- und Siedepunkt.
2.3 Van-der-Waals-Kräfte
Bei Schmelz- und Siedetemperaturen bestimmter Stoffe spielen Van-der-Waals-Kräfte und Molekülmasse eine wichtige Rolle. In der organischen Chemie gibt es oftmals sehr lange Kohlenstoffketten. Diese haben aufgrund der Van-der-Waals-Kräfte hohe Schmelz- und Siedepunkte. Allgemein gilt, dass langettige Kohlenwasserstoffe meist bei Raumtemperatur fest sind.
Je länger die Kohlenstoffkette ist, desto höher liegen Schmelz/- und Siedepunkt, da in langen Ketten die statistische Wahrscheinlichkeit für VdW-Kräfte höher ist. Dies gilt insbesondere für unverzweigte Kohlenstoffketten.
(Bild)
Durch die ständige Elektronenbewegung in einem Atom treten temporäre Teilladungen (auch momentane Dipole genannt) auf, nämlich immer dann, wenn es einen Elektronenschwerpunkt auf einer Seite, eine sogenannte asymmetrische Ladungsverteilung, gibt. Die Ursache ist einfach, dass Elektronen sich bewegen. Deshalb sind auch die Bindungselektronen nie genau mittig zwischen zwei Atomen, sondern mal eher auf einer Seite oder der anderen. Das Element, welches kurzzeitig mehr Bindungselektronen hat, ist kurzzeitig negativ geladen.
Van-der-Waals-Kräfte beschreiben somit die Wechselwirkung zwischen Atomen über die temporären Dipole.
Obwohl Van-der-Waals-Kräfte nur kurzzeitig und nicht beständig auftreten, kann ihre Summe in großen (langkettigen) Molekülen sogar größer sein als die der Kraft von elektrostatischen Wechselwirkungen!
Beispiel: Ethan Nonan
Schmelztemperatur: -172°C -54°C
Siedetemperatur : -89°C 151°C
Je länger die Kohlenstoffkette ist, umso wahrscheinlicher ist es, dass Van-Der-Waalskräfte auftreten, da es aufgrund der Länge viel mehr Möglichkeiten gibt, an denen diese zwischenmolekularen Kräfte auftreten können. Hinzu kommt, dass die Molekülmasse stetig ansteigt.
Die Molekülgestalt hat Einfluss auf die Van der Waals-Kräfte
Je verzweigter das Teilchen ist, desto schlechter können Van der Waals-Kräfte wirken (Skizze)
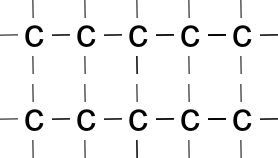
In diesem Beispiel liegen die unverzeigten Ketten dicht beieinander
=> hohe Anziehung durch VdW-Kräfte
Ist ein Molekül verzweigt, so können sich die Ketten nicht so stark annähern und somit sind die VdW-Kräfte wesentlich schächer! Bei einer, an mehreren Stellen verzweigten Kohlenstoffkette, gibt es, im Vergleich zu Isomeren ohne Verzweigung, nicht mehr so viele Möglichkeiten, an denen die Van-Der-Waalskräfte wirken können. Demnach liegen Siede/- und Schmelzpunkt niedriger.
Beispiel: Hexan 2,3-Dimethylbutan
Siedetemperatur: 69°C 58°C
Weitere Informationen: Diese drei Kräfte werden auch in dem Kapitel Zwischenmolekulare Kräfte erklärt.
