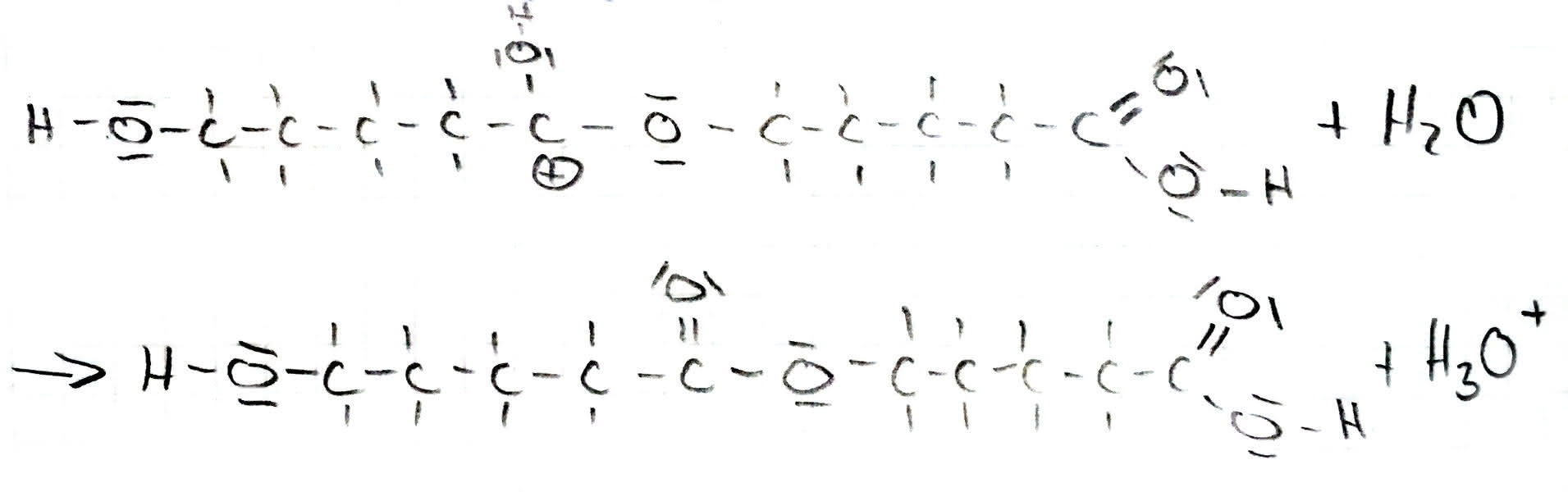Name: Oliver Schad, 2015
Was sind Ester?
Ester sind die Verbindungen mit der funktionellen Gruppe: R1-COOR2
Ester entstehen bei der Reaktion einer organischen Säure und eines Alkohols. Dabei wird immer Wasser abgespalten (Hydrolyse genannt).
Ester sind kaum wasserlöslich und haben ihre Bezeichnung von „Essig-Äther“ (Ethylacetat).
Benennung der Ester:
a) Nach beiden Komponenten und der funktionellen Gruppe
b) Nach dem Prinzip Rest Alkohol mit „-yl“ + Grundkörper der Säure und Endung „oat“ gebildet
c) Nach ihren Trivialnamen, die sich aus den Trivialnamen der Salze der Säuren ableiten
Wichtige Eigenschaften der Ester:
Geringe Polarität -> minimale Wasserlöslichkeit
Abnehmende Wasserlöslichkeit mit steigender Kohlenstoffkettenlänge
Reagieren in Wasser neutral, also nicht als Säure
Siedepunkte im Vergleich zu Alkoholen/ Carbonsäuren gleicher Länge wesentlich niedriger
Aromatischer Duft
Verwendung als Aromastoff in Lebensmittelindustrie
Vorkommen in Früchten
Der Mechanismus der Veresterung:
Die Veresterung lässt sich am besten in 5-Schritte aufteilen:
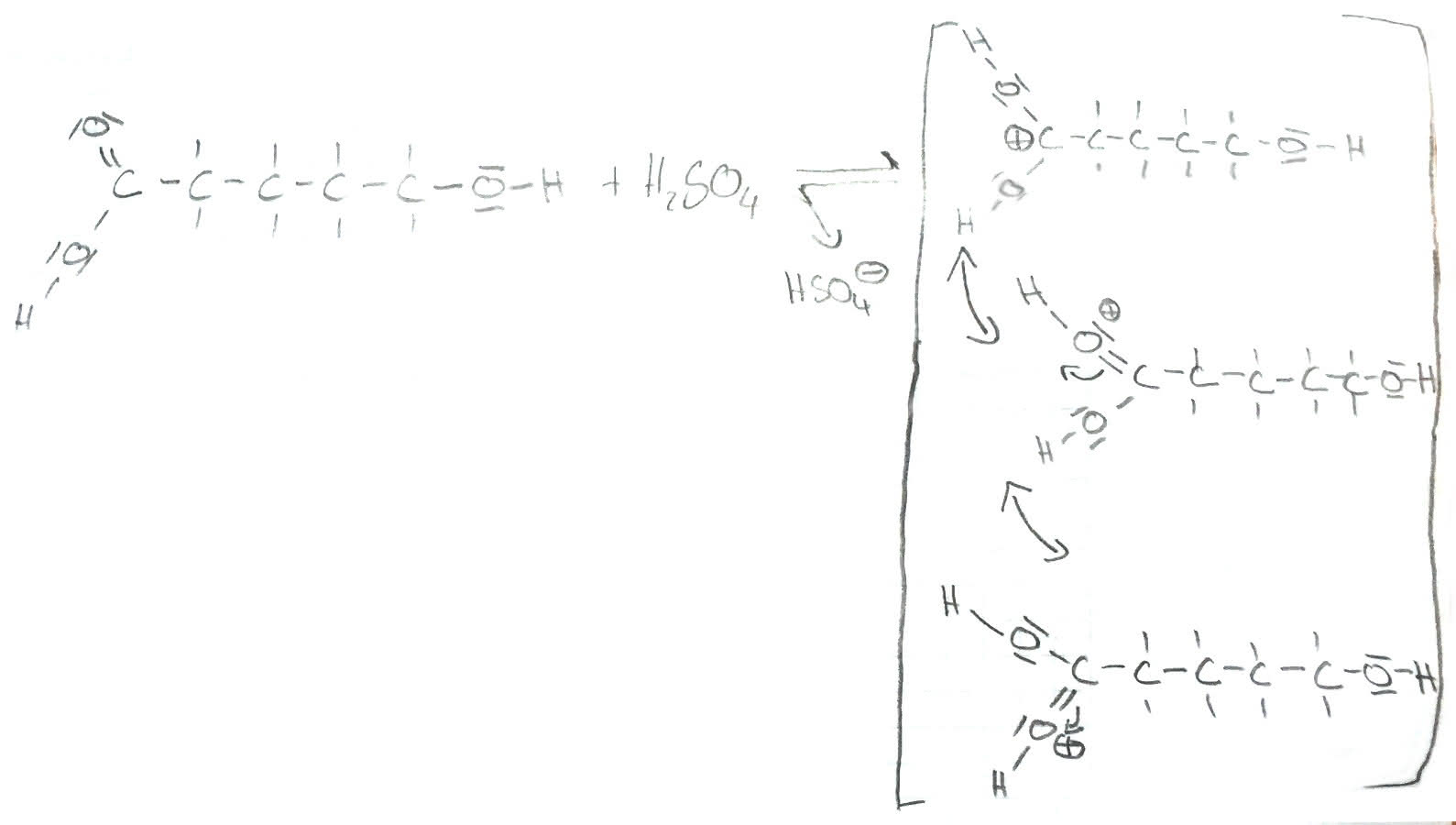
1. Protolyse durch Schwefelsäure
2. Additionsreaktion
3. Innermolekulare Reaktion
4. Abspaltung von Wasser
5. Katalysatorabspaltung
Beschreibung des Reaktionsmechanismus am Beispiel von 5-Hydorxypentansäure:
1.Schritt:
Im ersten Schritt findet die Protolyse der 5-Hydroxypentansäure statt. Die Schwefelsäure reagiert als Protonendonator und protoniert die Säure. Dadurch entstehen drei verschiedene Mesomerie-Strukturen der protonierten Säure. HSO4- bleibt als Nebenprodukt übrig.
2. Schritt:
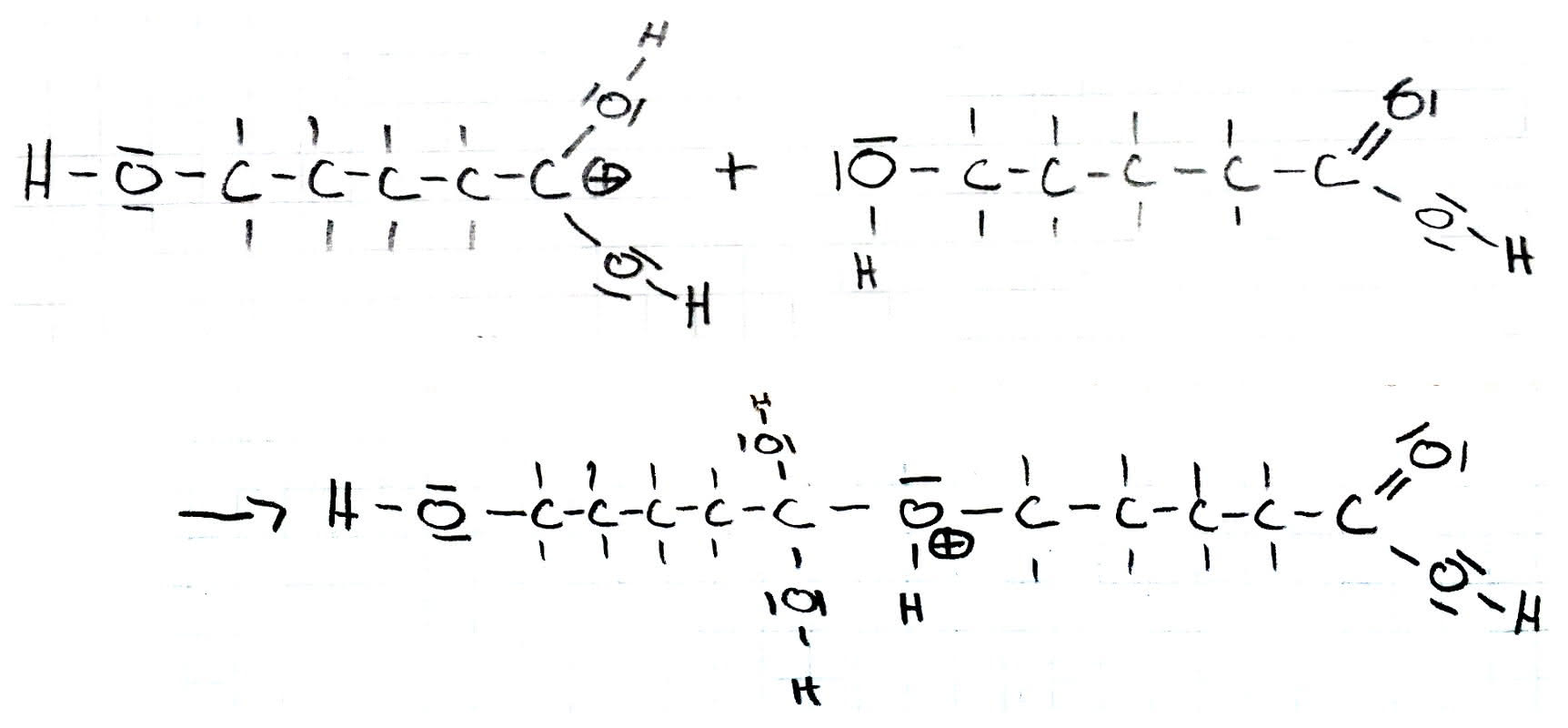
Im nächsten Schritt reagiert das entstandene Carbeniumion mit der Carbonsäure. Hier findet eine Additionsreaktion statt. Die freien Elektronen des Sauerstoffatoms der Hydroxy-Gruppe binden sich mit der positiven Ladung des Kohlenstoffatoms. Die positive Ladung bleibt erhalten und lässt sich nun am Sauerstoffatom der ehemaligen Hydroxy-Gruppe finden.
3.Schritt:
Danach reagiert das Produkt innermolekular. Eine innermolekulare Protolyse findet statt, bei der eine mittelständige Hydroxy-Gruppe das Wasserstoffatom der positiven Sauerstoffverbindung angreift und das Wasserstoffatom seine Bindungselektronen wegen der Elektronegativitätsdifferenz bei der Sauerstoffatom zurücklässt, sodass das Wasserstoffatom nun an der Hydroxy-Gruppe bindet und dort die positive Ladung ist.

4.Schritt:
Durch den vorherigen Schritt kann nun Wasser vom Molekül abgespalten werden, sodass Wasser und ein Carbeniumion entstehen.

5.Schritt
Zuletzt findet die Katalysatorabspaltung statt, bei der das Wasserstoffatom der Hydroxy-Gruppe am positiven C-Atom mit Wasser zum Oxoniumion reagiert. H+ wird abgespalten und das freie Elektronenpaar „klappt“ zur Doppelbindung um. Ein Estermolekül entsteht.