Chemie
- Details
- Zugriffe: 53374
Name:
Jakob U.,
Svea H. 2017-01
Übersicht über verschiedene zwischenmolekulare Kräfte
1. Ionenbindung
- Ionenbindungen sind chemische Bindungen, die auf der elektrostatischen Anziehung positiv und negativ geladener Ionen basieren.
- Eine Ionenbindung liegt ab eine Elektronegativitätsdifferenz von 1,8 liegt vor.
- Grob kann man sagen, dass eine Ionenbindung zwischen Elementen vorkommt, die links im Periodensystem stehen und Elementen die rechts im Periodensystem stehen.
- Die Bindung entsteht durch die elektrostatische Anziehung entgegengesetzt geladener Teichen (+ und -).
- Die Ionen sind regelmäßig in einem Ionengitter angeordnet und bilden häufig Kristalle (Ionenkristalle).
- Ionenbindungen haben hohe Schmelz- und Siedepunkte.
- Die starken Anziehungskräfte können durch Lösungsmittel wie z.B. Wasser überwunden werden.
- Die Atome wollen den energieärmsten Zustand, die Edelgaskonfiguration erreichen: Dies geschieht entweder durch Abgabe von Elektronen durch Elemente mit geringer Elektronegativität (links im PSE) oder durch Elektronenaufnahme der Elemente mit höherer Elektronegativität (rechts im PSE). Im ersten Fall entstehen mehrfach positiv geladene Kationen und im zweiten Fall einfach oder mehrfach negativ geladene Anionen.

- Verbindungen mit Ionenbindungen sind stromleitend in der Schmelze oder in Lösung.
- Verbindungen mit Ionenbindungen sind hart und spröde.
- Ionenkristalle sind oft farblos, da die Valenzelektronen meist stark gebunden sind und nur durch Photonen höherer Energie als der des sichtbaren Lichtes angeregt werden können.
- Alle Salze bestehen aus Ionen, welcher durch eine Ionenbindung miteinander verbunden sind.
- Ionogene Verbindungen haben die höchsten Schmelz- und Siedepunkte.
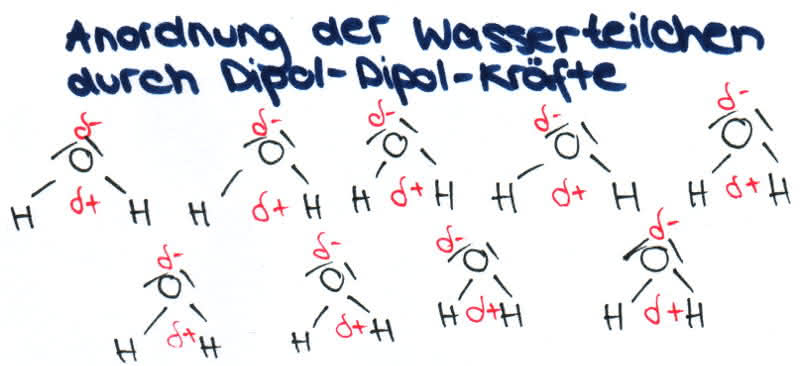
2. Dipol-Dipol-Kräfte/-Wechselwirkungen
-Dipole sind schwache Ladungen innerhalb von Molekülen, sie kommen durch ungleiche Ladungsverteilungen zustande.
-Sie sind permanent, d.h. immer vorhanden.
-Die Ursache dieser ungleichen Ladungsverteilungen sind die verschiedenen Elektronegativitäten der Elemente. Dabei werden die Bindungselektronen zu dem elektronegativeren Atom hin angezogen, wodurch dieses negativ und das andere positiv geladen wird.
-Dipolmoleküle bilden lockere Verbände, sogenannte Molekülaggregate.
-Die Anziehungen durch die Dipol-Dipol-Kräfte sind viel geringer als die zwischen Ionen und wirken nur über kurze Entfernungen.
-Die Dipol-Dipol Kräfte haben eine Wirkung auf die Höhe der Schmelz- und Siedepunkte: Wenn Dipol-Dipol-Wechselwirkungen vorliegen, so erhöhen sich Schmelz- und Siedepunkt.
3. Wasserstoffbrückenbindungen
-Wasserstoffbrückenbindungen herrschen zwischen Wasserstoffatomen und freien Elektronenpaaren.
-Sie führen zu einer schwachen Anziehung zwischen Molekülen und bilden somit ein "Raumnetz".
-Sie beeinflussen ebenfalls Schmelz- und Siedepunkte: Je mehr Wasserstoffbrückenbindungen gebildet werden können, desto höher sind Siedepunkt und Schmelzpunkt
- Sie liegen ebenfalls permanent vor.
- Sie bilden sich beispielsweise auch zwischen Wasserstoff und Stickstoff, oder Halogenmolekülen.
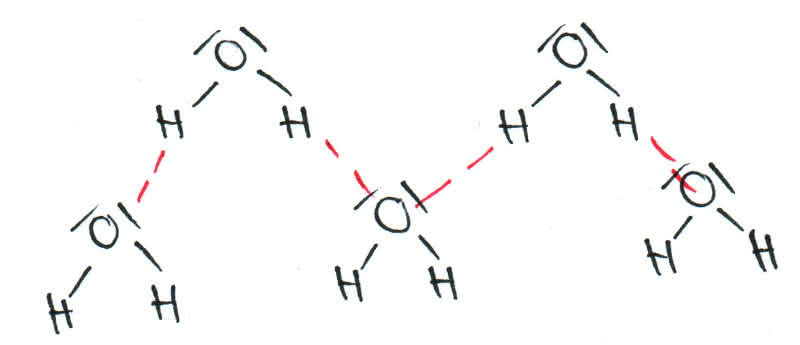
Wasserstoffbrücken liegen vor, wenn zwei funktionelle Gruppen der Form R1−X−H und |Y−R2 über Wasserstoffatome in Wechselwirkung stehen. Diese Bindung tritt aber nur auf wenn X elektronegativer als H ist und wird dadurch begünstigt, dass Y ebenfalls elektronegativ ist. Deshalb stellen Stickstoff (N), Sauerstoff (O) und Fluor (F) als elektronegative Atome eine besondere Bedeutung. Man stellt die Wasserstoffbindung oft in der Form R1−X−H…|Y−R2 als gepunktete Linie dar. Es liegen also Partiell Ladungen vor ,sodass X und Y eine negative und H eine positive Teilladung besitzen.
Diese spielen eine besondere Rolle bei Wasser und dessen Eigenschaften.
4. Van der Waals-Kräfte
Die Ladungen einer Atombindung in Molekülen sind wegen der Bewegung der Moleküle nicht in jedem Moment symmetrisch verteilt.
-Es liegt eine asymmetrische Elektronenverteilung vor, d.h. zu einem bestimmten Zeitpunkt befinden sich wesentlich mehr Elektronen auf der einen als auf der anderen Seite des Atoms.
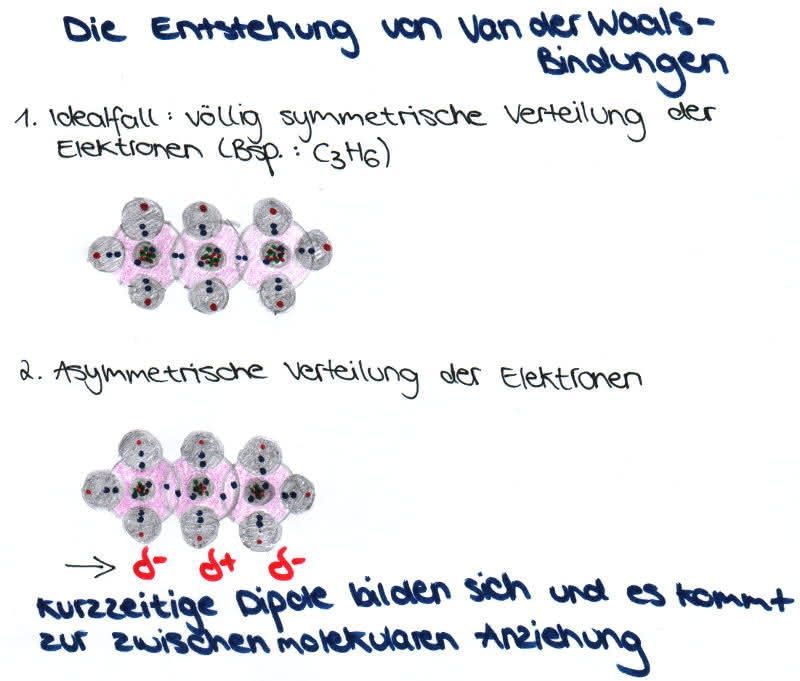
-Dadurch entstehen momentane, kurzzeitige Dipole, die allerdings nur sehr schwach sind, sich schnell verschieben und eine geringe Reichweite haben (sie sind also nicht permanent vorhanden!).
-Van der Waals-Kräfte treten nur bei Atomen und apolaren Molekülen auf.
Die Stärke der Van der Waals-Kräfte hängt ab von:
1. Der Elektronenanzahl im Atom: Je mehr Elektronen vorhanden sind, desto stärker ist die asymmetrische Verteilung, desto stärker sind die Dipole.
2. Der Zahl der Atome im Molekül, je höher die Molekülmasse, desto stärker sind die Van der Waals-Kräfte.
3. Der Zahl der Berührungsstellen.
4. Abstand der Moleküle --> 2 Moleküle/Atome müssen sich sehr nahe kommen für Wechselwirkungen
5. Die Annäherung ist umso schwieriger, je verzweigter die Moleküle sind.
- Die Viskosität einer Flüssigkeit nimmt ab, je höher die Temperatur ist, also je mehr kinetische Energie die Moleküle haben. Mit steigender Temperatur reißen die Van der Waals-Bindungen auf. Dies ist bei nicht ionogenen Flüssigkeiten in der Regel der Übergang vom flüssigen zum gasförmigen Zustand.
- Geckos nutzen Van der Waals-Kräfte, um an senkrechten Flächen zu klettern: Sie haben dazu Haftballen unter ihren Füßen, mit vielen feinen Härchen. Durch jedes kleine Härchen kommt es ein wenig zur Anziehung, also zur Wechselwirkung mit der glatten Oberfläche. Durch die hohe Anzahl der Härchen, können Geckos sogar kopfüber unter Glas laufen.
