Name: Lara Post, 2021-02
Energetische Betrachtung allgemein:
Da das Lösen bzw. Knüpfen von chemischen Bindungen mit Energieumwandlungen verbunden ist, läuft jede chemische Reaktion, also auch organische Reaktion, unter Energiebeteiligung ab.
Hierbei wird beispielsweise Energie die in Stoffen gespeichert ist (= innere Energie) zu einer anderen Energieform umgewandelt (Lichtenergie, thermische Energie,...). Es geht also nie Energie verloren (Energieerhaltungssatz!), sondern sie wird nur umgewandelt und z.B. an die Umgebung abgegeben.
Exotherme und endotherme Reaktionen
Die meisten Reaktionen laufen bei Raumtemperatur nicht selbstständig ab. Um die Reaktion zu starten, muss Energie zugeführt werden, welche Aktivierungsenergie genannt wird. Dies kann beispielsweise mithilfe eines Bunsenbrenners (Wärme) geschehen. Durch die Aktivierungsenergie wird das System in einen instabilen Zustand versetzt.
- Bei einer exothermen Reaktion läuft die Reaktion anschließend ohne weitere Energiezufuhr selbständig ab. Insgesamt bilanziert gibt das System Energie an die Umgebung ab (typische exotherme Reaktion: Verbrennung).
- Bei einer endothermen Reaktion hingegen muss nach dem Hinzufügen der Aktivierungsenergie auch weiterhin andauernd Reaktionsenergie hinzugeführt werden. Würde diese Energiezufuhr unterbrochen werden, würde die Reaktion stehen bleiben. Die Reaktion gibt also in der Gesamtbilanz keine Energie an die Umgebung ab, sondern nimmt welche auf.
Übergangszustand:
Ein Zustand, in dem maximale Energie herrscht, wird Übergangszustand genannt.
Zwischenprodukt:
Ein Zwischenprodukt ist ein Reaktionsprodukt, welches zwar bei einer chemischen Reaktion entsteht, aber nicht isoliert werden kann. Anstatt dessen wird es weiter umgesetzt.
Besonderheiten bei der radikalischen Substitution:
Die Energiebilanz der radikalischen Substitution ergibt, dass die neu gebildeten Bindungen energieärmer sind als die aufgebrochenen Bindungen, weshalb das Energiediagramm mit einem höheren Wert startet als es endet. Die Reaktion ist somit stark exotherm.
Im ersten Schritt wird durch Licht- oder Wärmeenergie die schwächste Bindung aufgebrochen. Durch die homolytische Spaltung entstehen die Radikale. Der folgende Schritt des Angriffs des Radikals, der Abspaltung beispielsweise von Chlorwasserstoff wodurch ein Methyl-Radikal entsteht und dem brechen der C-H Bindung und bilden der H-Cl Bindung ist leicht exotherm.
Dem Diagramm kann man entnehmen, dass dieser einleitende Schritt mit einer großen Aktivierungsenergie verbunden ist. Der zweite Schritt, die Bildung beispielsweise von Chlormethan, ist dagegen stark exotherm und somit für die große Triebkraft der Reaktion verantwortlich.
Energiediagramm radikalischen Substitution:
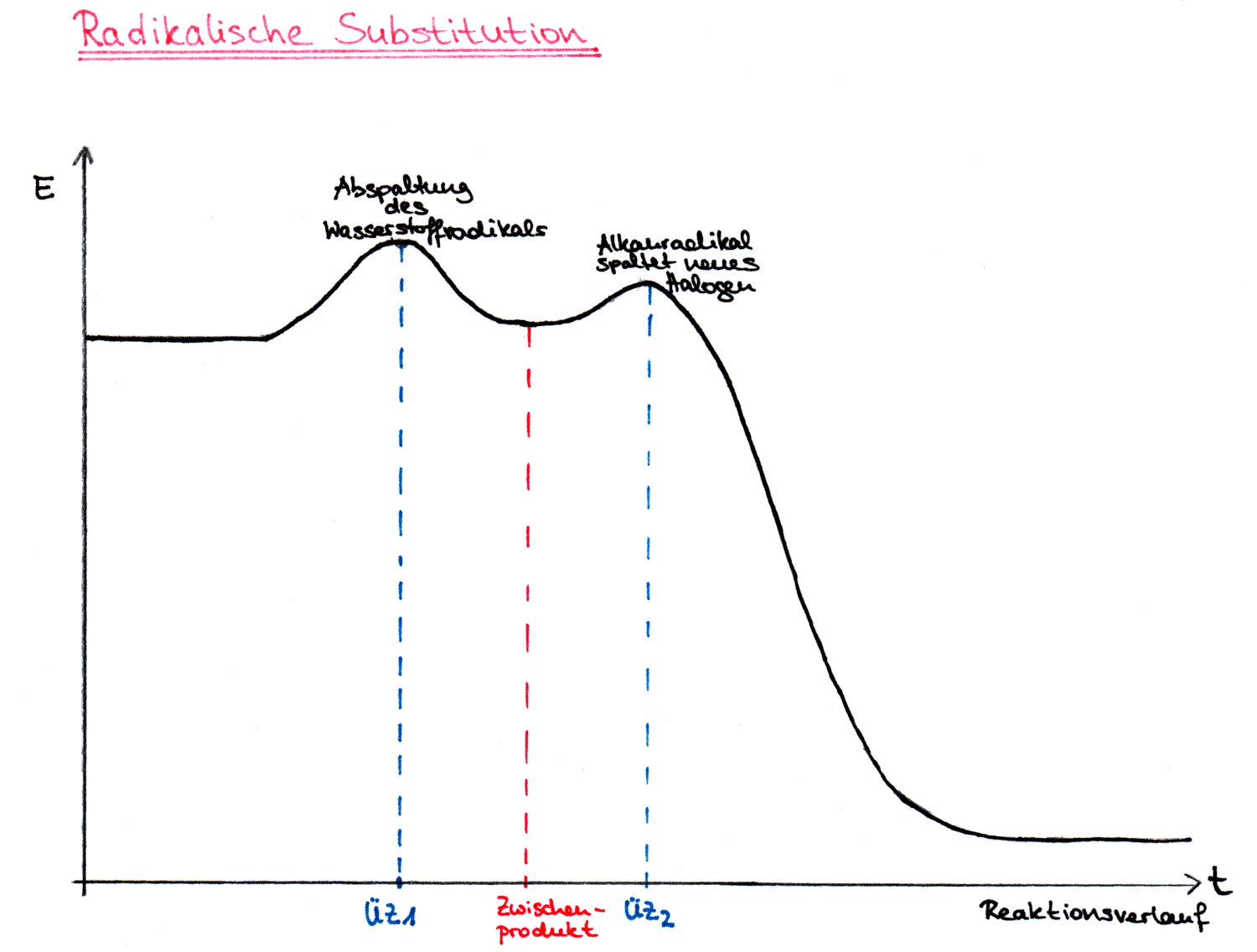
Energiediagramm radikalische Substitution
Besonderheiten bei der elektrophilen Addition:
Nach der Aktivierung der Reaktion folgt der Übergangszustand 1, welcher zum energetisch ungünstigeren primären Carbeniumion führt, welches zwar in einem Energieminimum liegt, aber aufgrund des hohen Energieniveaus instabil ist. Der erste Übergangszustand liegt energetisch höher als der Übergangszustand 2, der zum tertiären Carbeniumion führt. Übergangszustand 2 benötigt nur einen sehr geringen Energiebetrag, weswegen er sehr schnell abläuft.
Insgesamt ist die Energiebilanz der elektrophilen Addition exotherm, da das Energieniveau am Anfang höher ist als am Ende der Reaktion.

Energiediagramm elektrophile Addition
Besonderheiten bei der nukleophilen Substitution:
SN1:
Die Reaktion verläuft in zwei Schritten. Es entsteht also ein Zwischenprodukt und zwei Übergangszustände. Nach der Aktivierung der Reaktion steigt die Energie und es folgt der erste Schritt, welcher geschwindigkeitsbestimmend (= am langsamsten) ist. Nach dem ersten Energiemaximum, welches durch die Abspaltung des Wassers entsteht, folgt im Energieminimum ein reaktives Zwischenprodukt, welches im zweiten Schritt (zweites Maximum des Diagramms) angegriffen wird. Dieser zweite Schritt verläuft im Verhältnis zum ersten Schritt sehr schnell. Das Energieniveau am Ende ist deutlich geringer als zu Beginn der Reaktion. Somit ist die Reaktion exotherm.
Die Reaktion findet stufenweise statt.
SN2:
Die Reaktion läuft ohne nachweisbare Zwischenprodukte ab und besitzt nur einen Übergangszustand, da es während der Reaktion kein Energieminimum gibt. Der Mechanismus ist somit konzentriert und nicht stufenweise.
Zu Beginn nach dem Einsetzen der Aktivierungsenergie steigt die Energie der Reaktion bis sie ihr Maximum und ihren Übergangszustand erreicht. Nach der gleichzeitigen Abspaltung und dem rückseitigem Angriff des Halogenions fällt die Energie auf ein Energieniveau, welches unter dem des Starts der Reaktion liegt. In der Energiebilanz ist die Reaktion also exotherm, da sie mehr Energie freigibt als sie aufnimmt.
Energiediagramm nukleophilen Substitution:
Energiediagramm nukleophile Substitution

