Chemie
- Details
- Zugriffe: 19247
Name: Anastasia Martens, 2021-06
Fette und Öle sind Gemische aus verschiedenen Triglyceriden. Diese unterscheiden sich in den unterschiedlichen, gebundenen Fettsäuren. Jede Fettsäure hat einen individuellen Siede- und Schmelzpunkt.
Daher haben Fette und Öle typischerweise keine eindeutigen Siede- und Schmelzpunkte, sondern Siede- und Schmelzbereiche.
=> Der Schmelzbereich eines Fettes hängt von der Zusammensetzung der Triglyceride ab und dabei maßgeblich von den gebundenen Fettsäuren ab. Je mehr Doppelbindungen diese haben, desto eher ist das Fett bei Raumtemperatur flüssig.
Bei Raumtemperatur flüssige Fette werden auch Öle genannt.
Allgemein steigt der Schmelzpunkt einer Fettsäure mit zunehmender Kohlenstoffkettenlänge der gebundenen Fettsäuren, da mehr Van-der-Waals-Kräfte ausgebildet werden können, wenn die Kontaktfläche zwischen den unterschiedlichen Molekülen größer ist.
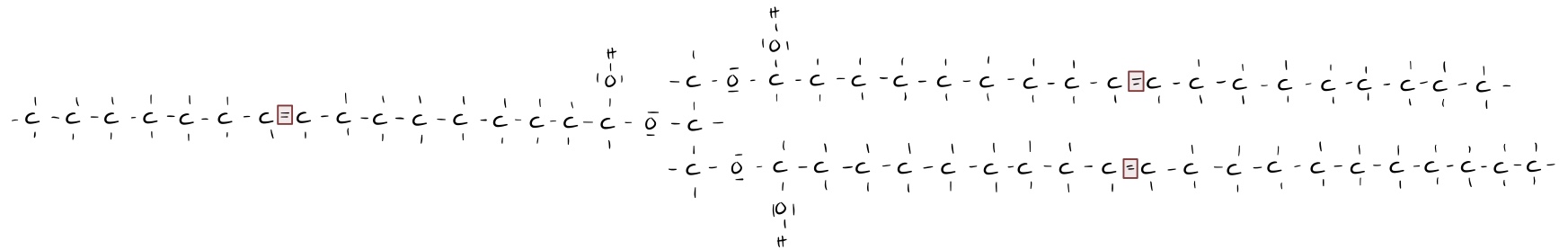
Ein anderer Faktor, der die Höhe des Schmelz- und Siedebereichs bestimmt, ist die Anzahl der einfach und mehrfach ungesättigten Fettsäuren, die an den entsprechenden Triglyceriden gebunden sind. Aufgrund der Doppelbindungen innerhalb der Kohlenstoffkette ändert sich der räumliche Bau, indem ein "Knick" entsteht. Dies führt dazu, dass die intermolekulare Ausbildung von Van-der-Waals-Kräften gestört wird und die Schmelz- und Siedebereiche somit niedriger sind.
Sind also lange gesättigte Fettsäuren innerhalb eines Fettmoleküls gebunden, handelt es sich um ein festes Fett (bei Raumtemperatur fest). Diese Fette sind meist tierischer Herkunft. Sind hingegen Fettsäuren mit vielen Doppelbindungen gebunden, handelt es sich um ein fettes Öl (bei Raumtemperatur flüssig). Diese Fette sind meist pflanzlicher Herkunft.
Ausnahmen bestätigen aber die Regel: Kokosfett und Lebertran
Kokosfett (ein pflanzliches festes gesättigtes Fett)
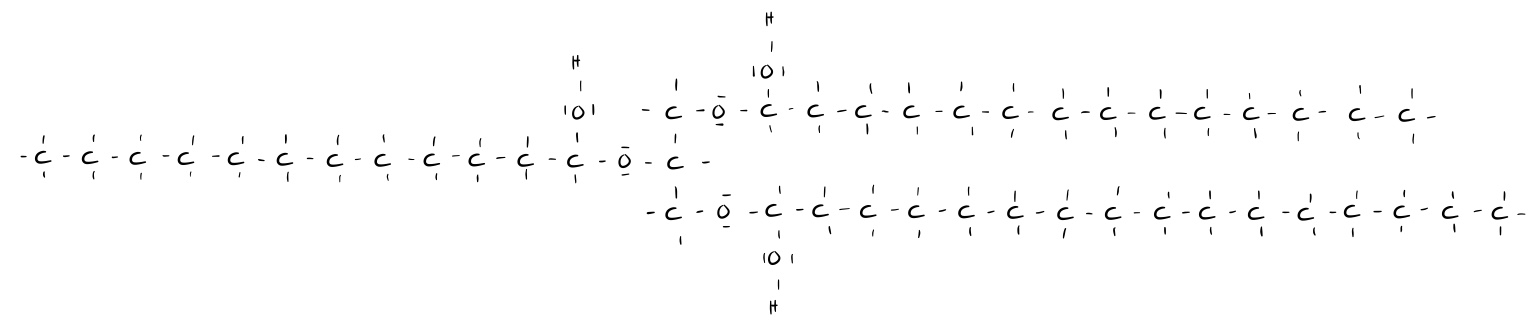
Lebertran (ein tierisches Öl, ungesättigt)
Fette und Öle haben Siede- und Schmelzbereiche.
Je länger die Kohlenstoff-Ketten der gebundenen Fettsäuren und je höher die Anzahl der gebundenen gesättigten Fettsäuren, desto stärker sind die Van-der-Waals-Wechselwirkungen.
=> hohe Siede- und Schmelzbereiche
Je höher die Anzahl der gebundenen einfach oder mehrfach gesättigten Fettsäuren, desto verzweigter ist das Fett-Molekül bezüglich seines räumlichen Baus. Dies führt zu einer geringeren intermolekularen Kontaktfläche, was die Ausbildung von Van-der-Waals-Wechselwirkungen beeinträchtigt.
=> niedrige Siede- und Schmelzbereiche
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
