Chemie
- Details
- Zugriffe: 12008
Name: Jakob Melamed, 2024-04
Das Erste, woran man wohl denkt wenn man das Wort "Nylon" hört, sind vermutlich Strümpfe, dabei bietet die reißfeste und elastische Struktur des Nylons viel mehr Anwendung als nur auf der Haut.
Bild 1: https://commons.wikimedia.org/wiki/File:Nylon_stockings.jpg
Autor : Tranquil Garden; Lizenz: https://creativecommons.org/licenses/by-sa/3.0/deed.en
Ein Großteil der Nylonproduktion findet in der Textilindustrie statt, da es sich hierbei um einen Stoff handelt, der nicht nur reißfest und elastisch ist, sondern auch schön glänzend ist und dabei auch nicht knittert. Da Nylon auch mit einer hohen Festigkeit und Hitzebeständigkeit von bis zu 150°C glänzen kann, wird es auch zur Herstellung von technischen Teilen wie Dübeln oder ganz alltäglichen Gegenständen wie z.B. Pfannenwendern verwendet.
Bild 2: https://commons.wikimedia.org/wiki/File:Fischer_Universald%C3%BCbel_UX_10_aus_Biowerkstoff-8365.jpgAutor : Raimond Spekking; Lizenz: https://creativecommons.org/licenses/by-sa/4.0/deed.en
Bild 3: https://commons.wikimedia.org/wiki/File:Nylon_spatula.jpg
Autor : Vanischenu; Lizenz: https://creativecommons.org/publicdomain/zero/1.0/deed.en
Tatsächlich handelt es sich bei diesem Stoff um das Produkt eines organischen Reaktionsmechanismus, der Polykondensation. Für die Synthese von Nylon schauen wir uns die Polykondensation von einem Diamin und einer Disäure an. In dem Fall ist unsere Disäure Hexan-1,6-disäuredichlorid bzw. Adipinsäuredichlorid beim Diamin handelt es sich um Hexan-1,6-diamin bzw. Hexanmethylendiamin.

Hexan-1,6-dichlord / selbst gezeichnet

Hexan-1,6-diamin / selbst gezeichnet
Im folgenden wird der Reaktionsmechanismus beschrieben, welcher uns den Grundbaustein für Nylon liefert :
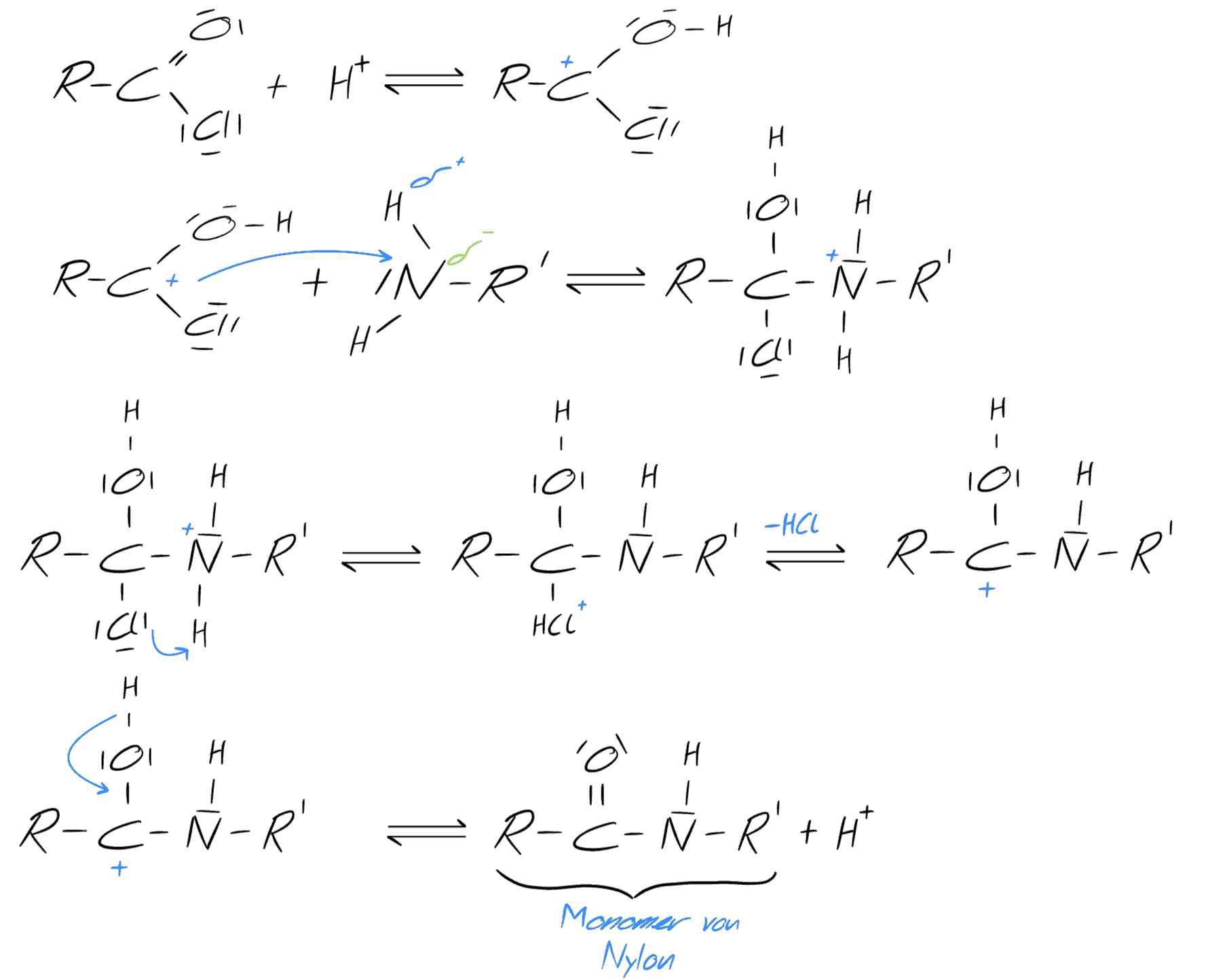
Mechanismus: Nylonherstellung - selbst gezeichnet
Das Ergebnis des Mechanismus ist ein sogenanntes Monomer. Diese Reaktion lässt sich wiederum an dem Ende des Monomers durchführen und man erhält Stück für Stück einen längeren Faden. Man kann sich dieses Prinzip wie bei Legosteinen vorstellen, dabei entspricht ein Monomer einem Klemmbaustein und je mehr Klemmbausteine wir anhängen, desto größer wird unser Faden, der theoretisch bis ins Unendliche wachsen kann. Beim verbinden der Monomere entstehen die gewünschten Stoffe - die Polymere.
Bild 4: https://commons.wikimedia.org/wiki/File:Red_lego_brick.png
Autor : BoxOfNotes; https://creativecommons.org/publicdomain/zero/1.0/deed.en
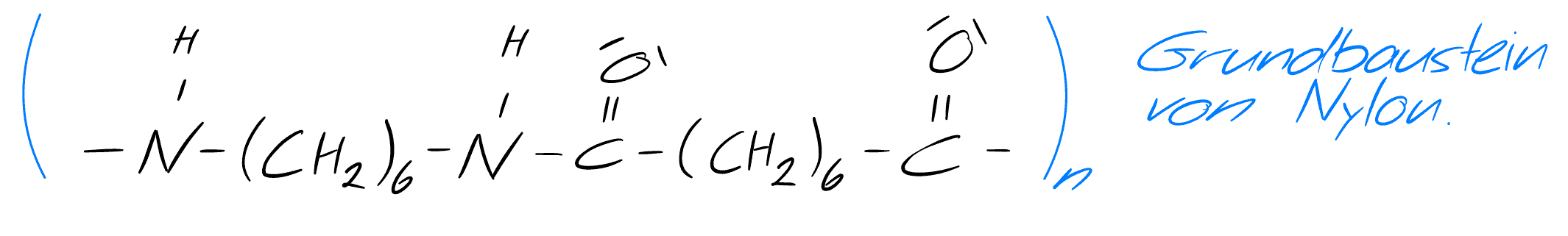
Grundbaustein Nylon - selbst gezeichnet
Um das Nylon jetzt auch noch einem Versuch herzustellen, benötigt man ca. 25 Minuten Zeit und folgende Materialien :
- 2 Bechergläser 100 ml
- 1 hohes Becherglas 1000 ml
- Glasstab
- Spatel
- Pinzette
- Einwegpipetten
- Waage
Versuchsdurchführung : Grenzflächenkondensation
- In einem Becherglas werden 1 ml Adipinsäuredichlorid in 30 ml Heptan gelöst.
- Im zweiten Becherglas werden 2 g Natriumcarbonat und 0,8 g Hexamethylendiamin in 40 ml Wasser gelöst. Es werden einige Tropfen Phenolphthalein und Natronlauge hinzu getropft.
- Die erste Lösung muss nun vorsichtig über die zweite gegossen werden, sodass 2 Phasen entstehen, zwischen diesen muss eine Grenzfläche sichtbar werden.
- Ziehe mit einer Pinzette vorsichtig an der Haut einen dünnen Faden heraus der sich gebildet hat und rolle den Faden um ein hohes 1-Liter-Becherglas auf. Der Faden
sollte sich nicht berühren. Ermittle über den Kreisumfang des Becherglases und die
Anzahl der Windungen die ungefähre Länge des Fadens.
Der Versuch muss mit Brille und Handschuhe bestenfalls unter dem Abzug durchgeführt werden!
Bild 5: https://commons.wikimedia.org/wiki/File:Nylon.jpg
Autor : Superplus at German Wikipedia; https://creativecommons.org/licenses/by-sa/3.0/deed.en
Hinweise :
- Da die Edukte giftig sind, ist es wichtig, dass alle Reste miteinander reagiert haben. Dies sollte z.B. durch Umrühren nach Versuchsende sichergestellt werden.
- Das Reaktionsprodukt ist im Abzug zu belassen, bis das Heptan
über Nacht verdampft ist. Ein Stück des auf dem Becherglas aufgewickelten Fadens muss unter Wasser gespült werden und sollte dann noch im feuchten Zustand abgewickelt und im Abzug zum Trocknen aufgehängt werden. - Der getrocknete Faden ist nicht besonders elastisch, da bei Schulversuchsbedingungen keine besonders langen Polymere entstehen können.
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
