Chemie
- Details
- Zugriffe: 15045
Name: Hannah Müller, 2022-03
Vorkommen von Pektinen:
Pektine sind Bestandteil pflanzlicher Zellwände z.B. in Stängeln, Blüten und Blättern, wo es festigend und wasserregulierend wirkt. So haben Citrusfrüchte v.a. in den harten Schalen einen hohen Pektinanteil, weiche Erdbeeren hingegen einen geringen.
Aufbau von Pektinen:
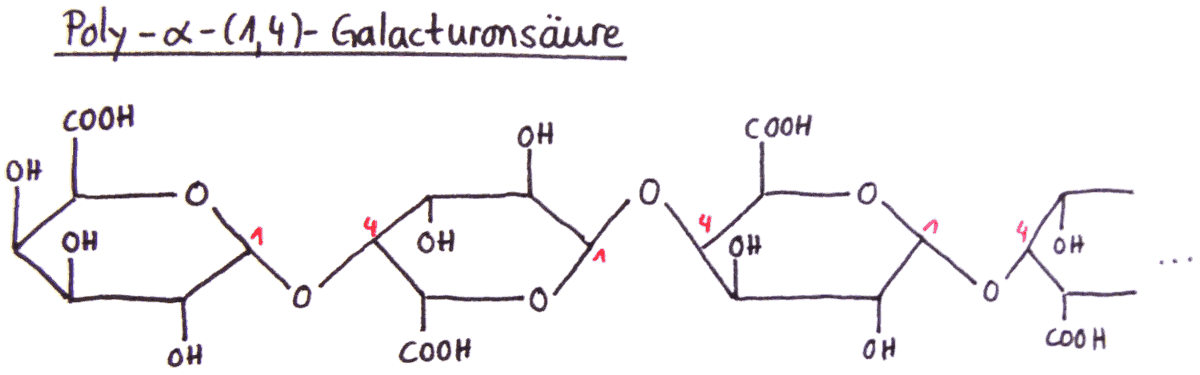
Bei Pektinen handelt es sich um pflanzliche Polysaccharide, die vor allem aus α-D-Galacturonsäure-Monomeren bestehen, die über 1,4-glycosidische Bindungen miteinander verknüpft sind.
Dieses Galacturonsäure-Polymer, welches auch als Poly- α-(1,4)-Galacturonsäure bezeichnet werden kann, bildet jedoch nur das geradlinige Grundgerüst des Pektinmoleküls.
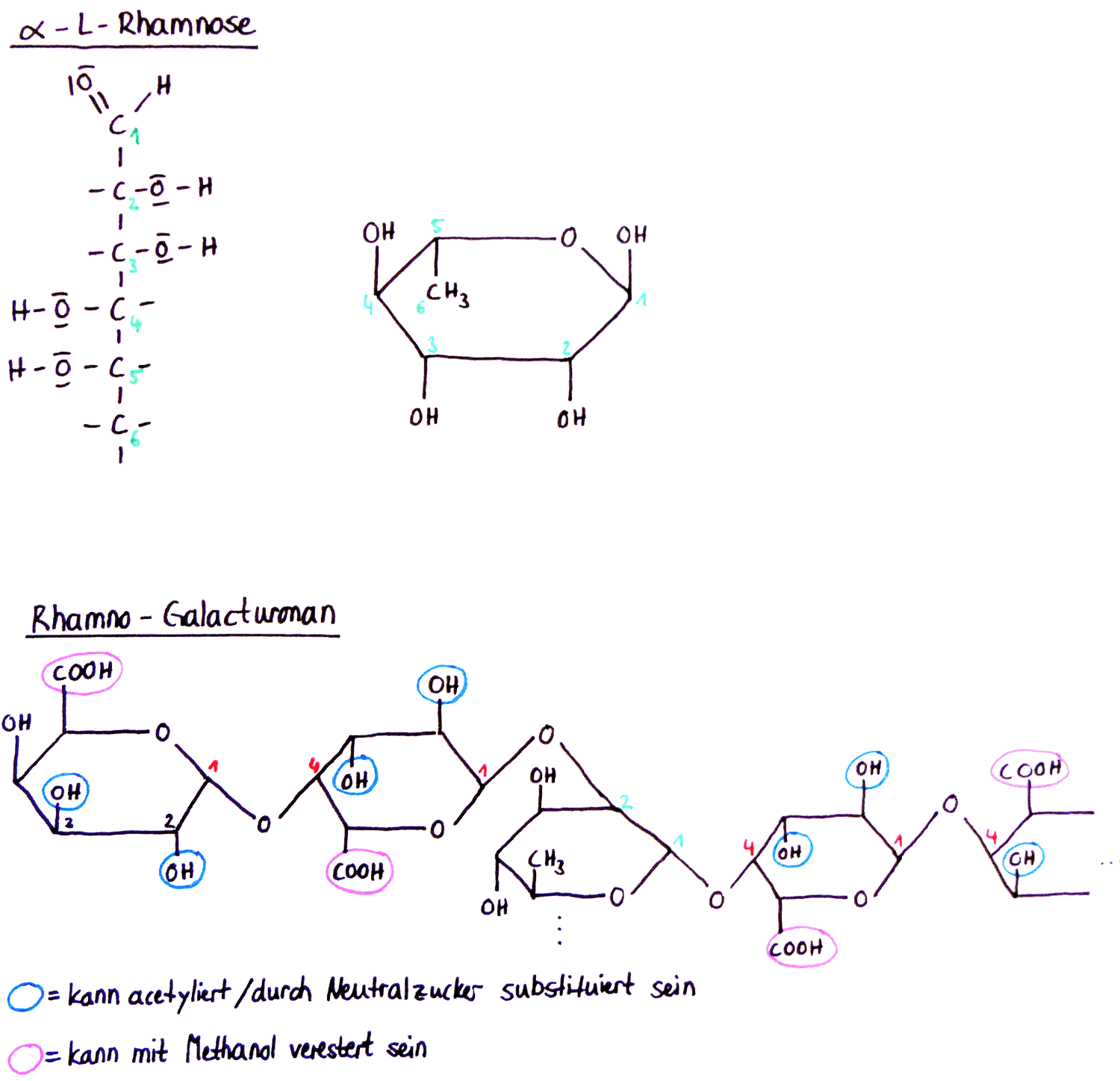
Ein weiterer wichtiger Bestandteil sind nämlich α-L-Rhamnose-Monomere, die gelegentlich über 1,2-glycosidische Bindungen in die Galacturonsäurekette eingebunden sind und hierdurch „Knicke“ im ursprünglich linearen Grundgerüst verursachen. Diese Molekülkette wird Rhamnogalacturonan genannt. (Beachte übrigens auch, das α-L-Rhamnose eines der wenigen Kohlenhydrate ist, welches natürlich in der L-Form und nicht der D-Form vorkommt!).
An den Rhamnosemolekülen hängen zudem noch verschiedene Seitenketten, welche aus 1-50 Molekülen der Zucker Xylose, Arabinose und Galactose bestehen. Diese Verzweigungen treten in unregelmäßigen Abständen auf, sodass man zwischen hairy regions (viele Verzweigungen) und smooth regions (keine Verzweigungen -> lineares Gerüst) unterscheidet. Überwiegend an den hairy regions kann es vorkommen, dass die Hydroxygruppen der C2 und C3-Kohlenstoffatome der Galacturonsäuremoleküle acetyliert oder durch Neutralzucker substituiert sind. Zudem sind die Carboxylgruppen der Galacturonsäuremoleküle häufig mit Methanol verestert. Die Ausgeprägtheit der Veresterung und Acetylierung hat Einfluss auf die chemischen Eigenschaften des Pektins, weshalb die Klassifizierung von Pektinen nach ihrem Veresterungsgrad erfolgt.
Gelierende Wirkung der Pektine:
Pektine sind gut in Wasser löslich, obwohl es sich bei Pektinen um Makromoleküle handelt. In Wasser dissoziieren sie nämlich, indem die Carboxylgruppen Protonen abgeben, wodurch anionische Säurereste entstehen. Die Pektine stoßen sich nun nicht nur aufgrund dieser negativen Ladungen gegenseitig ab; zusätzlich bilden sich auch Hydrathüllen an den Säureresten, da es zu Ion-Dipol-Wechselwirkungen zwischen dem Dipol des Wassers und den negativen Resten des Pektins kommt, sodass Pektine also auch eine Viskosität erhöhende Wirkung haben. In diesem Zustand sind die Abstände zwischen den einzelnen Polymeren jedoch so groß, dass der Zustand der Lösung beibehalten wird – Pektin geliert also nicht von selbst!
Damit jedoch eine gelierende und stabilisierende Wirkung eintritt, sich die Moleküle also in gleichmäßigen Strukturen anordnen, muss einer der beiden Geliermechanismen stattfinden:
1) Bei niederverestertem Pektin:
Kationen (z.B. Ca2+) mit mehrfach positiver Ladung binden mehrere der negativ geladenen Carboxylatgruppen, sodass sich die Moleküle aufgrund der Ladungsaufhebung annähern und durch Wechselwirkungen ein Gel, bestehend aus einem Molekülnetzwerk, entsteht, in dem die Kationen eingeschlossen werden.
2) Bei hochverestertem Pektin:
Durch die Zugabe von Säure werden deren Protonen auf die anionischen Pektinreste übertragen, was die elektrostatische Abstoßung der Pektine aufhebt. Die Hydrathüllen können zudem über die Zugabe von Zucker reduziert werden, da dieses durch Osmose Wasser bindet. Dies ermöglicht eine Annäherung der Pektine, welche (teilweise auch mit dem Zucker) durch Wasserstoffbrückenbindungen ein Molekülnetzwerk bilden.
(Diese Methode wird z.B. bei der Herstellung von Marmelade angewandt: Hierbei wird zu den Früchten Gelierzucker (Zucker + Pektin) und bei Bedarf Zitronensäure zugefügt.)
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik