Chemie
- Details
- Zugriffe: 9053
Name: Elisabeth.L. 2023-01
Die Oxidation eines Alkohols
Eine Oxidation ist eine chemische Reaktion eines Ion oder eines Atoms, bei denen der zu oxidierende Stoff Elektronen abgibt und somit die Oxidationszahl erhöht. Dies kann bei bei Redoxreaktionen und Verbrennungen stattfinden. Natürlich kann diese Reaktion auch bei Alkoholen stattfinden.
Dabei muss immer auf die Wertigkeit der Alkohole geachtet werden. Denn je nach Aufbau, kann eine, zwei oder keine Oxidation ohne Aufbrechung der Struktur stattfinden.
Primäre Alkohole
Primäre Alkohole sind erkennbar durch die OH-Gruppe, die an einem Kohlenstoffatom hängt, welches nur mit einem weiteren Kohlenstoffatom verbunden ist.
Diese Alkohole reagieren leicht mit Sauerstoff. Durch die erste Oxidation oxidiert das Alkohol zu einem Aldehyd. Dabei verändert sich die Hydroxygruppe zu einer Oxogruppe. In Nomenklauturformeln werden Aldehyde durch die Endung -al gekennzeichnet.
Der Name der Aldehyde kann aus der Dehydrierung des Alkohols hergeleitet werden. Kurzkettige Aldehyde sind lipophil, werden jedoch mit größer werdenden Ketten lipophob. Aldehyde werden unter anderem in Desinfektionsmitteln, Parfümen und als Konservierungsmitteln in Kosmetika verwendet.
Aldehyde können ein weiteres Mal oxidiert werden, da es ihnen ihre Strukturformel ermöglicht. Sie oxidieren dann zu Carbonsäuren, die erkennbar an den Carboxy-Gruppen sind.
Carbonsäuren werden durch den Suffix (Endung) -säure in Nomenklaturformeln gekennzeichnet.
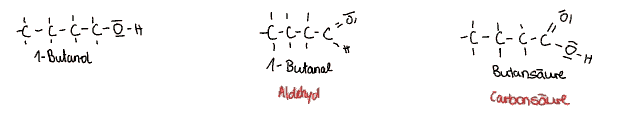
Carbonsäuren besitzen einen sauren Charakter auf Grund ihrer starken Polarität. Es gibt verschieden Arten der Säure, die abhängig von verschiedenen Faktoren sein kann (Anzahl der Carboxygruppen, Aufbau der Kohlenstoffkette mit eventuellen weiteren funktionellen Gruppen). Die Eigenschaften der Carbonsäuren ändern sich durch zunehmende Länge der Kohlenstoffkette.
Sekundäre Alkohole:
In sekundären Alkoholen ist die OH-Gruppe mit einem Kohlenstoffatom verbunden, welches in der Mitte von zwei weiteren Kohlenstoffatomen sitzt (also zwei benachbarte Kohlenstoffatome besitzt).

Bei sekundären Alkoholen kann nur eine Oxidation stattfinden. Sie reagieren zu einem Keton, welches durch ein Sauerstoffatom anstelle der OH-Gruppe gekennzeichnet wird.

Ketone sind unterschiedlich, je nachdem wie lange ihre Ketten sind. Kurzkettige Ketone sind flüssig, farblos, brennbar und leichtflüchtig. Ihr Geruch ist intensiv und meist aromatisch (fruchtig). Sie sind hydrophil, durch ihre polare Carbonylgruppe, sind aber auch etwas lipophil. Je länger die Kohlenstoffkette wird, desto unpolarer werden die Ketone. Längerkettige Ketone sind feste Stoffe, die die Eigenschaften der kurzkettigen Ketone eher weniger vorweisen.
Wegen einem mangelnden Angriffspunkt kann das entstandene Keton nicht weiter oxidiert werden.
Ketone werden häufig in Lösungs- und Reinigungsmitteln verwendet und lassen sich in der Natur in Aromastoffen und Geschlechtshormonen finden.
Tertiärer Alkohol:
Tertiäre Alkohole sind erkennbar durch die drei C-Atome, die an das C-Atom gebunden sind, an welchem die Hydroxygruppe hängt.
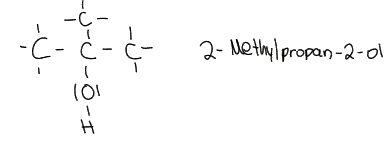
Ein tertiärer Alkohol kann nicht oxidiert werden, es sei denn man bricht die Struktur auf. Dabei entsteht dann Kohlenstoffdioxid.
Die Oxidation der Alkohole gilt auch als Möglichkeit Isomerie nachzuweisen, so zum Beispiel sind Aldehyde und Ketone Carbonyl-Gruppen und durch Isomerie an verschiedenen Stellen in der Verbindung möglich. Um diese Isomerie zu erkennen, muss man nun also die Verbindung oxidieren lassen, um herauszufinden, ob es ein Keton oder Aldehyd ist.
Dazu kann man zum Beispiel die Fehling-Probe nutzen, bei dem die Verbindung die Farbe ändert, wenn ein Aldehyd vorhanden ist. Eine weitere Methode des Nachweises ist die Silberspiegelprobe, die sowie die Fehlingprobe nur als Nachweis für Aldehyde gilt.
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
