Chemie
- Details
- Zugriffe: 7530
Name: Hannah Müller, 2021-06
Optische Aktivität
Die optische Aktivität beschreibt die folgende physikalische Stoffeigenschaft von bestimmten Enantiomeren einer Verbindung, welche die Polarisation (Schwingungsebene) von Licht drehen können. Durch die Elektronen in dem Molekül wird ein elektrisches Feld aufgebaut, welches mit dem Licht in Wechselwirkung tritt. Im Folgenden wird das durchscheinende Licht polarisiert. Dieses Phänomen tritt nur bei Verbindungen auf, die ein chirales C-Atom enthalten und als zwei zueinander spiegelbildliche Enantiomere vorkommen, weshalb es sich hierbei auch um das einzige Unterscheidungskriterium zweier Enantiomere handelt.
Milchsäure beispielsweise hat zwei Enantiomere, welche das Licht in jeweils entgegengesetzte Richtungen polarisieren.

Milchsäure in D- und L-Form
Ob und in welche Drehrichtung die Rotation bei einer bestimmten Verbindung erfolgt, kann nicht durch den räumlichen Bau hergeleitet werden; die den Milchsäuremolekülen entsprechenden Enantiomeren von Milchsäuremethylester zum Beispiel haben entgegengesetzte Drehrichtungen.

Milchsäure-methylester
Die optische Aktivität muss also experimentell ermittelt werden. Dazu dient das Polarimeter:
Polarimeter
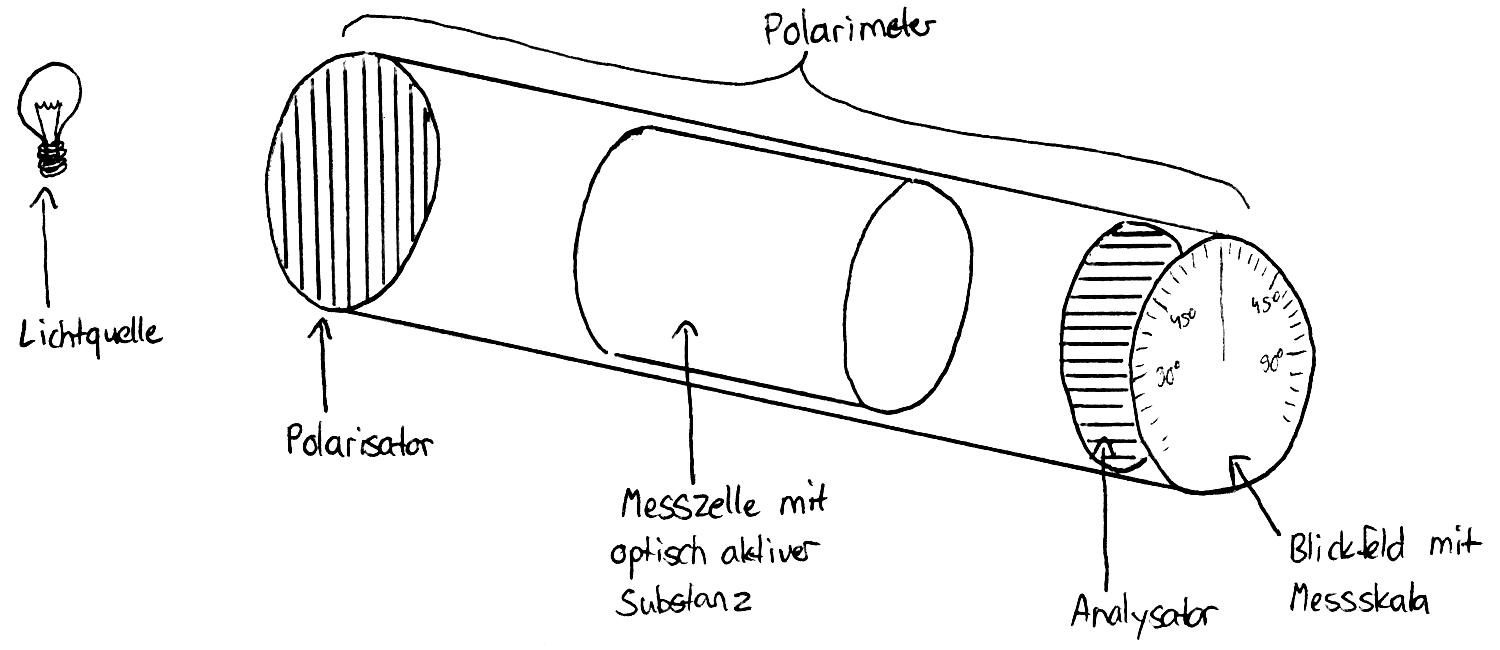
Hierzu eignet sich der Versuchsaufbau des Polarimeters: Vor einer Röhre ist der erste Polarisationsfilter, der Polarisator, angebracht. Er lässt nur linear polarisiertes Licht durch, welches im nächsten Schritt in der Röhre auf die Messzelle mit der zu untersuchenden Substanz trifft. Der zweite Polarisationsfilter (Analysator) hinter der Messzelle kann durch Drehen so eingestellt werden, dass das polarisierte Licht hindurch kommt: Wenn die Polarisation des Lichts also nicht mit der Ausrichtung des Filters übereinstimmt, tritt kein Licht hindurch. Ist der Analysator im Verhältnis zum Polarisator um 90° gedreht und es befindet sich keine Messzelle in der Röhre, so bleibt das Blickfeld dunkel.
Wird nun die Messzelle mit der optisch aktiven Substanz gefüllt, wird die Schwingungsebene des Lichts gedreht. Dadurch wird das Blickfeld heller. Zur Bestimmung des Drehwinkels des Stoffes wird der Analysator nun so lange gedreht, bis das Blickfeld komplett dunkel ist. Nun kann man an der Skala des Blickfelds den Drehwinkel der Substanz ablesen: Hierbei kann man feststellen, dass bestimmte Enantiomere linksdrehend (-) sind, also einen negativen Drehwinkel haben, während andere mit einem positiven Drehwinkel (+) rechtsdrehend sind. Diese beiden Enantiomere sind also optische Antipoden, ihre beiden Drehwinkel haben den gleichen Betragswert.
Der Drehwinkel α errechnet sich folgendermaßen:
α=[α] ⋅ l ⋅ β (Einheit: °⋅cm-3/(g⋅dm))
Hierbei entspricht [α] der spezifischen Drehung/ Rotation/ dem Drehwert, welche(r) typisch für die untersuchte Substanz ist. Die Massenkonzentration der optisch aktiven Substanz in der verdünnten Lösung = β und die Länge der Messzelle = l. Der Drehwinkel ist außerdem abhängig von Konzentration und Struktur der Substanz sowie Temperatur und der Wellenlänge des Lichts, sodass man mit einem Polarimeter auch die Konzentration einer Lösung bestimmen kann.
Sonderfall: Liegt ein Racemat, also eine Lösung, in der zwei Enantiomere im Verhältnis 1:1 gemischt sind, vor, wird die Schwingungsebene von durchscheinendem Licht nicht gedreht. Der Drehwert dieser Lösung entspricht 0°, da die beiden Enantiomere ihre jeweilige optische Aktivität gegenseitig aufheben.
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
