Chemie
- Details
- Zugriffe: 29364
Name: Seyma, 2021-06
Ungesättigte Fettsäuren
Eine ungesättigte Fettsäure ist eine langkettige Monocarbonsäure mit mindestens einer Doppelbindung. Ungesättigte Fettsäuren kann man durch Reaktionen an den Doppelbindungen nachweisen.
Um ungesättigte Fettsäuren nachzuweisen, kann man beispielhaft diese zwei Methoden verwenden:
a) Baeyer-Probe
In ein Reagenzglas, in dem sich die zu untersuchende Fettsäure befindet, wird eine alkalische Kaliumpermanganatlösung hinzugefügt. Das verschlossene Gefäß wird anschließend kurz geschüttelt. Enthalten die im Kaliumpermanganat gelösten Fettsäuren Doppelbindungen, so entfärbt sich die zunächst violette Substanz und scheint nach der ablaufenden Redoxreaktion braunfarben. Der Nachweis ist positiv. Nach der Reaktion ist die Doppelbindung innerhalb der Kohlenstoffkette aufgebrochen und es sind Braunstein, Manganat und ein Diol entstanden. Bei dieser Reaktion handelt es sich um eine Redoxreaktion, die die Entfärbung verursacht. Dabei wird Mangan sowohl oxidiert als auch reduziert. Die Spaltung der Doppelbindung und das addieren der OH-Gruppen ist mithilfe des Additionsverfahren verständlich.
Reaktionsgleichung der Bayer- Probe:
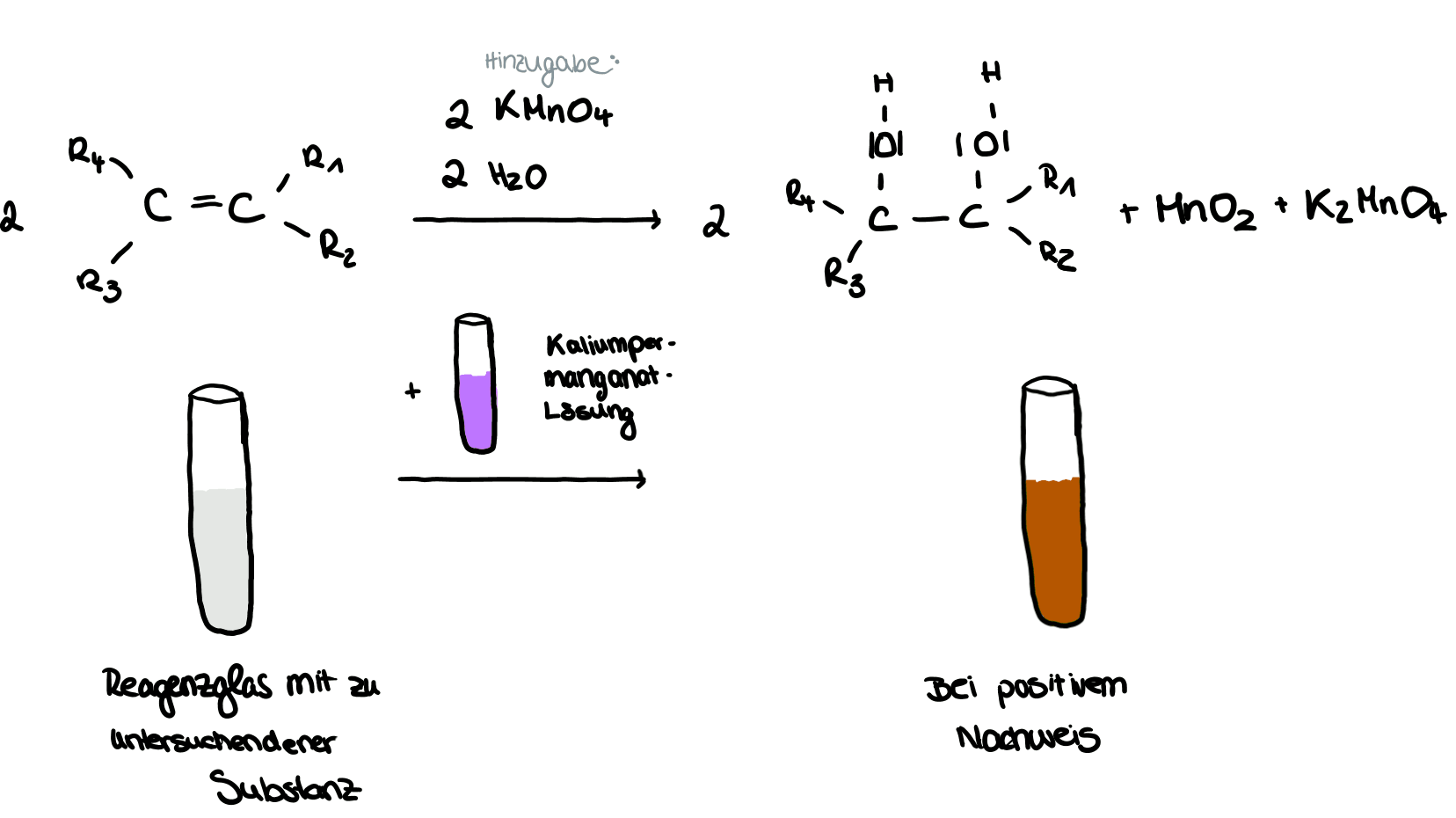
Nachweise für ungesättigte Fettsäuren - Bayer-Probe
b) Bromwasser
Bei der Hinzugabe von Bromwasser wird Brom unter Spaltung der Doppelbindung an die Kohlenstoffkette gebunden. Hierbei handelt es sich um eine elektrophile Addition (Halogenierung). Es muss nicht zwingend Brom der Reaktionspartner sein. Auch Iod kann die gleiche Reaktion auslösen. Allerdings sind dann die Farbreaktionen langsamer und auch unterschiedlich. Mithilfe von Iod lässt sich auch die Iodzahl bestimmen.
Dabei wird die Doppelbindung durch Brom (oder Iod) gesättigt und das elementare gelb-braune Brom (bzw. das braun-violette Iod) reagiert und verschwindet aus dem Ansatz. Dabei kommt es zur Entfärbung, da Halogenalkane (nahezu) farblos sind.
Fazit:
Ungesättige Fettsäuen findet man in Ölen. Sie enthalten Doppelbindungen, welche durch Kaliumpermanganat, Brom oder Iod nachgewiesen werden können. Dabei kommt es zur Entfärbung.
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
