Chemie
- Details
- Zugriffe: 24996
Name: Johanna Semler, 2021-02
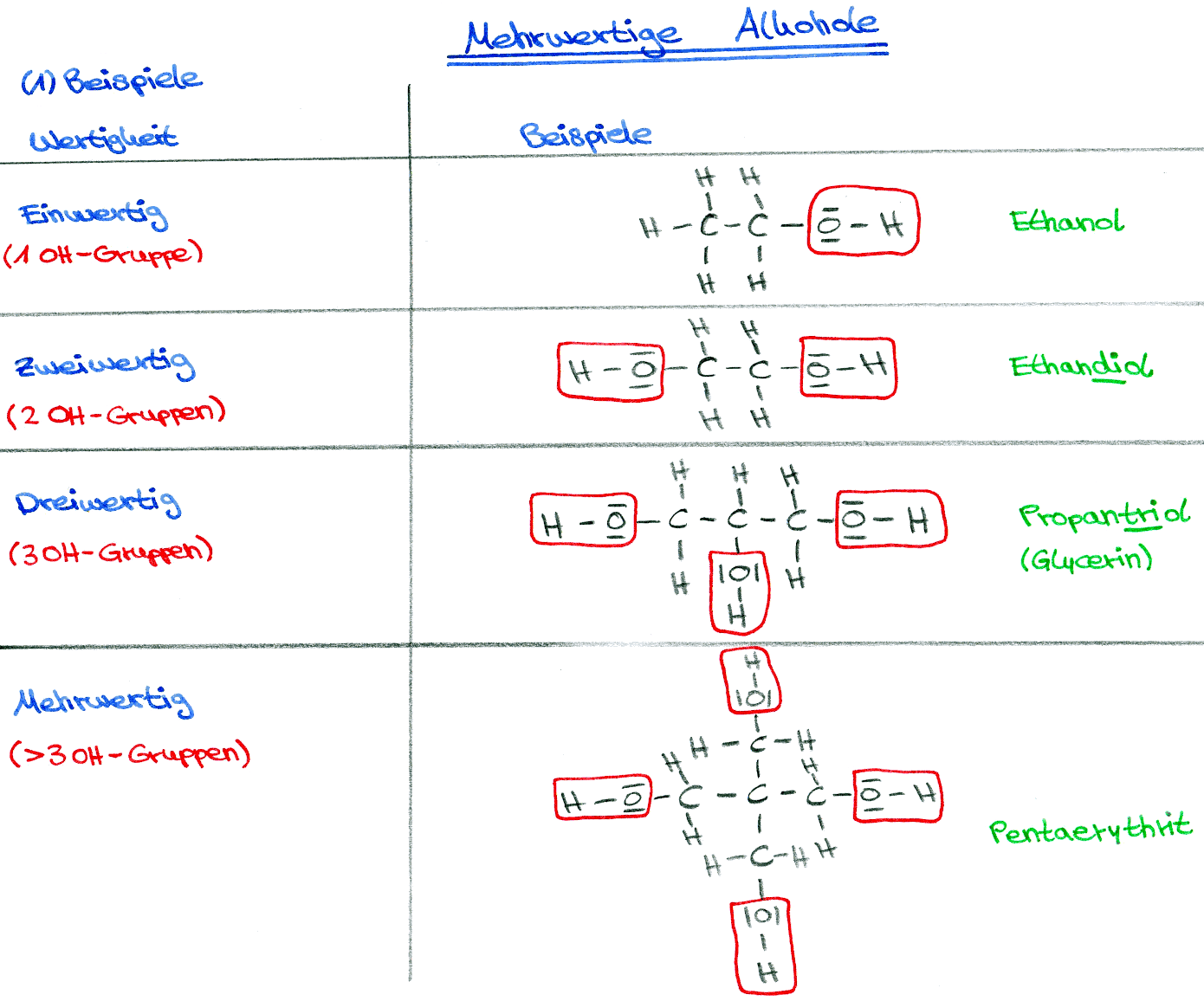
Als mehrwertige Alkohole bezeichnet man alle Alkanole mit mehr als einer OH-Gruppe, besonders aber Alkohole mit mehr als 3 OH-Gruppen. Mehrwertige Alkohole treten häufig in der Natur auf. Ihre Eigenschaften sind abhängig von der Anzahl der Hydroxygruppen.
Faustregel: Je mehr Hydroxidgruppen ein mehrwertiger Alkohol hat, desto süßer schmeckt er. Man nennt sie auch deswegen "Zuckeralkohole".
-
Wertigkeit
Anzahl an Hydroxygruppen
Einwertig
1 OH-Gruppe
Zweiwertig
2 OH-Gruppen
Dreiwertig
3 OH-Gruppen
Mehrwertig
< 3 OH-Gruppen
Beispiele für mehrwertige Alkohole:
Glycol (Ethan-1,2-diol)
H H
| |
O O
| |
H—C—C—H
| |
H H
-> Summenformel: C2H4(OH)2 (zweiwertiger Alkohol)
-> molare Masse: 62,1 g/mol
-> Siedepunkt: 197,8°C und Schmelzpunkt: -15,6°C
-> farblose, süßlich schmeckende, stark hygroskopische (wasseranziehende), viskose (zähflüssige) und giftige Flüssigkeit
-> tödliche Dosis: ca. 1,4 ml/kg Körpergewicht
-> rauschähnliche Zustände bei Diethylenglycol
Verwendung von Glycol:
-
Frostschutzmittel, Kühlmittel (Gemisch von Wasser und Glycol 1:1 gefriert erst bei -40°C)
-
Enteiser
-
Nebelfluid für Nebelmaschinen
-
Bestandteil von Liquids für E-Zigaretten
-
Herstellung von Kunststoffen, Druck- und Stempelfarben (z.B. Polyester bzw. PET)
-
Bremsflüssigkeitszusatz
-
Lösungsmittel für bestimmte Farbstoffe
-
Desinfektionsmittel
Glycerin (Propan-1,2,3-triol)
H H H
| | |
O O O
| | |
H—C—C—C—H
| | |
H H H
-> Summenformel: C3H5(OH)3 (dreiwertiger Alkohol)
-> molare Masse: 92,1 g/mol
-> Siedepunkt: 290°C und Schmelzpunkt: 17,9°C
-> ungiftige, süß schmeckende, geruchlose, hygroskopische, farblose und klare Flüssigkeit
-> mischbar mit Wasser
-> vorhanden in allen natürlichen Fetten und fetten Ölen, z.B. Pflanzenölen
-> Gewinnung aus Propen, bei der Verseifung von natürlichen Fetten und Ölen zur Gewinnung von Seifen, als Nebenprodukt der Biodieselherstellung sowie durch Fermentation.
Verwendung von Gylcerin
-
Zusatzstoff in Kosmetika wie Cremes oder Zahnpasta sowie in Tabak oder Druckfarben (Glycerin spendet Feuchtigkeit)
-
Für pharmazeutische Zwecke, Arzneistoff (z.B. Abführmittel)
-
Frostschutzmittel
-
Produktion von Schäumen
-
Nahrungsmittelindustrie (z.B. Getränkeherstellung oder in Kaugummi)
-
Kunststoff- und Sprengstoffindustrie (häufig bekannt als „Nitroglycerin“= Dynamit)
-
Futtermittel für Wiederkäuer, Schweine und Hühner
-
Plattformchemikalie
Sorbit (Hexan-1,2,3,4,5,6-hexol)
H H H H H H
| | | | | |
O O O O O O
| | | | | |
H—C—C—C—C—C—C—H
| | | | | |
H H H H H H
-> Summenformel: C6H8(OH)6 (mehrwertiger Alkohol)
-> molare Masse: 182,2 g/mol
-> Siedepunkt: 296°C und Schmelzpunkt: 95°C
-> sehr leicht löslich in Wasser, fester Aggregatzustand
-> Bestandteil vieler Früchte und in Rosengewächsen (wie z.B. Vogelbeere)
-> hoher Anteil an Sorbit in: Birnen, Pflaumen, Äpfeln, Aprikosen und Pfirsichen
-> industrielle Herstellung erfolgt aus Glucose (Traubenzucker)
-> weißes, kristallines Pulver mit einer Süßkraft von circa 40-60% im Vgl. zu Haushaltszucker
Verwendung von Sorbit
-
Zuckerersatz (besonders auch für Diabetikerlebensmittel) in vielen Lebensmitteln-
-
Ausgangsstoff für die Gewinnung von Ascorbinsäure (Vitamin C)
-
Feuchthaltemittel
-
Bestandteil der meisten Zahncremes
Übersicht über die mehrwertigen Alkohole /Alkanole
Übersicht über die mehrwertigen Alkanole
(Klicken zum Vergrößern)
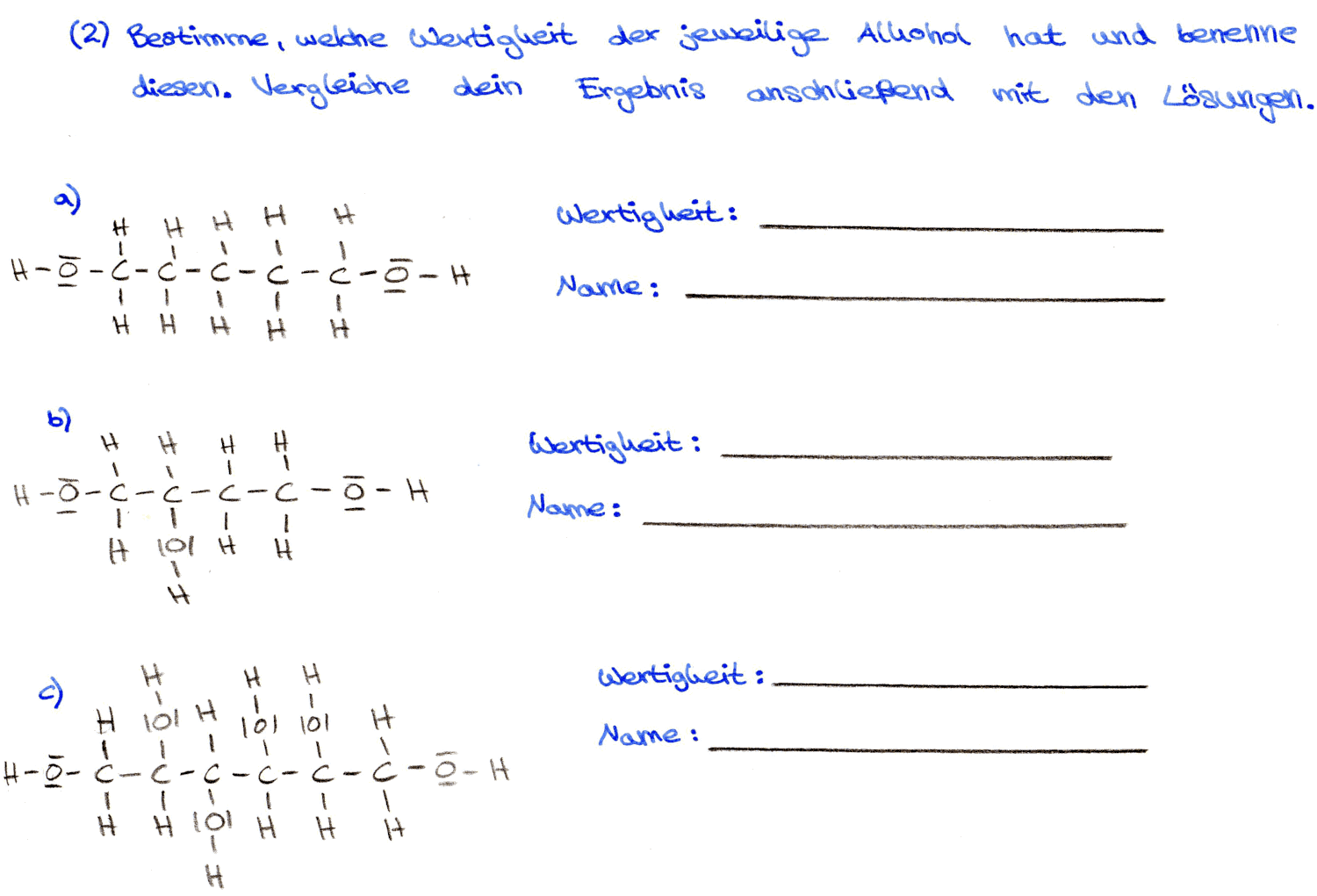
Aufgaben zu den mehrwertigen Alkoholen/Alkanolen
-------Achtung! Lösung unter der Linie-----
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik