Chemie
- Details
- Zugriffe: 10053
Name: Zara, 2021-06
Gies, Laurenz, 2023-01
Glucose
Glucose ist ein natürlich vorkommendes Kohlenhydrat. Man unterscheidet D-Glucose und L-Glucose. D-Glucose ist die natürlich vorkommende Form der Glucoseenantiomeren und wird auch als Traubenzucker oder Dextrose bezeichnet. Sie ist der am häufigsten vorkommende Monosaccharid (Einfachzucker). L-Glucose kann dahingegen ausschließlich synthetisch hergestellt werden.
Die Summenformel von Glucose lautet C6H12O6 und die molare Masse ist 180,16 g/mol. Bei Raumtemperatur liegt Glucose im festen Aggregatszustand vor. Die gute Wasserlöslichkeit ist eine wichtige Eigenschaft der Glucose hinsichtlich ihrer Beteiligung am Stoffwechsel und ihrer Rolle als Hauptenergiequelle bei lebenden Organismen. Die Herstellung von Glucose erfolgt über die enzymatische Spaltung von Stärke, was vorher in Form von Kohlenhydraten aufgenommen werden muss.
Menschen und Tiere speichern Glucose in Form von Glykogen und Pflanzen in Form von Stärke.
Glucose kann man in Fischer-Projektion und Haworth-Projektion darstellen.
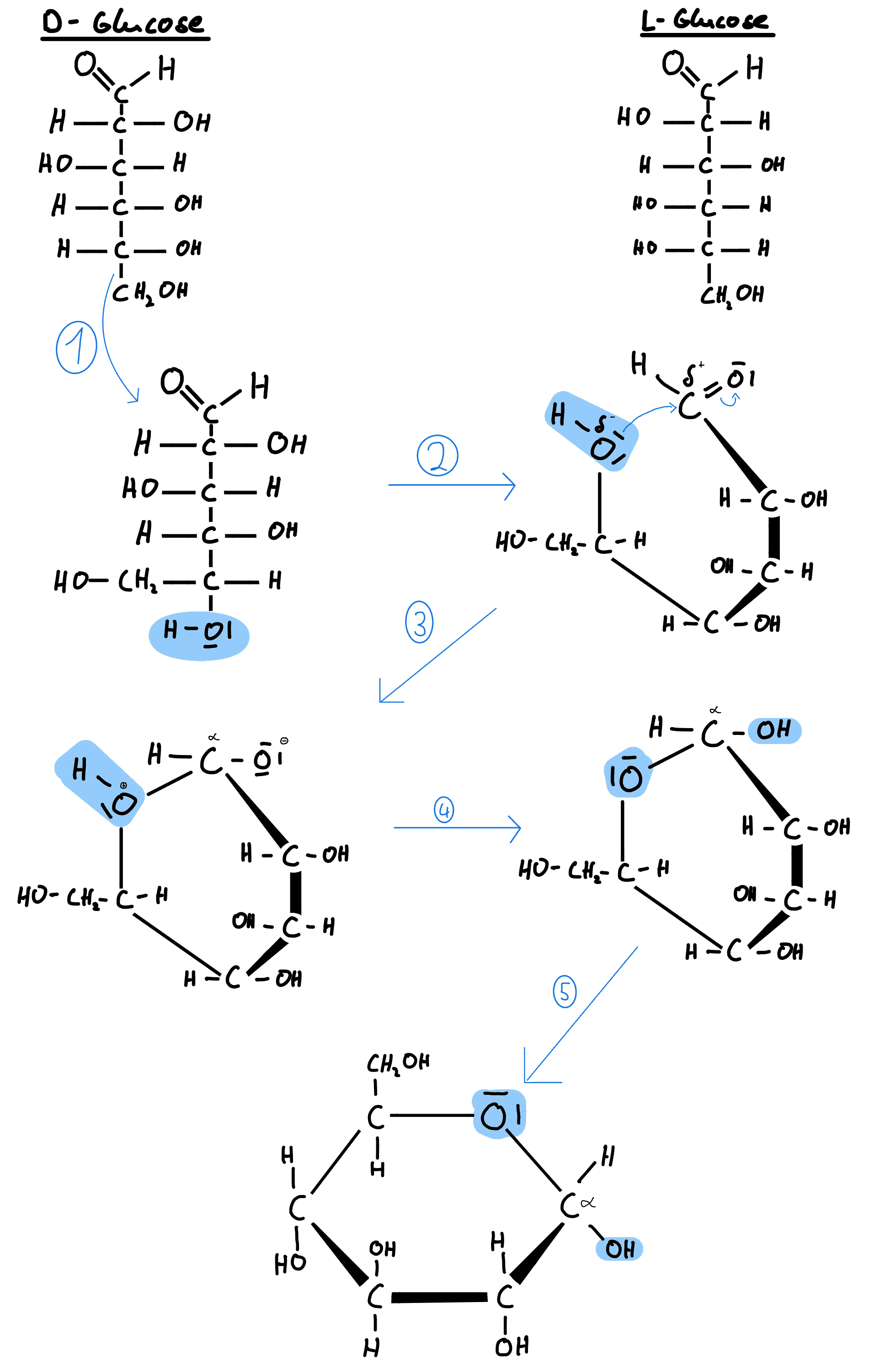
D- und L-Glucose in Fischer Projektion und D-Glucose in Haworth-Projektion
Bei der D-Glucose liegt in Fischer-Projektion die Hydroxygruppe am fünften Kohlenstoffatom rechts.
Jedoch liegen in wässriger Form weniger als 0,1% der Glucosemoleküle in Kettenform vor und und der Großteil in Ringform. Die Ringform bildet sich durch die intramolekulare Reaktion der Hydroxygruppe am C5 mit der Aldehydgruppe am C1. Die Reaktion liegt der nukleophilen Addition zugrunde, wobei als Reaktionsprodukt ein Halbacetal entsteht. Diese Ringform wird üblicher Weise in Haworth-Projektion dargestellt.
In der folgenden Abbildung wird gezeigt, wie schrittweise aus der Kettenform der Glucose die Ringform entsteht. (1) Es folgt zunächst eine Änderung der Position der Hydroxylgruppe am fünften Kohlenstoffatom. (2) Die Aldehydgruppe am ersten Kohlenstoffatom reagiert mit der Hydroxylgruppe des fünften Kohlenstoffatoms. (3) Durch die Partialladungen des Kohlenstoffatoms und des Sauerstoffs verbinden sich die beiden Atome durch die Elektronen des Sauerstoffs. (4) Das positiv geladene Sauerstoffatom gibt sein Wasserstoff an das negativ geladene Sauerstoffatom ab. (5) Hier wird ein Beispiel für die Struktur eines α-Zuckers gezeigt.
Glucose ist also eine Aldose mit sechs Kohlenstoffatomen im Molekül, wobei das Glucosemolekül überwiegend in Ringform als Halbacetal vorliegt.
Das Kohlenstoffatom der Aldehydgruppe (in Kettenform) wird durch die Ringbildung zu einem weiteren asymmetrisch substituierten Kohlenstoffatom, welches als anomeres Kohlenstoffatom bezeichnet wird.
Man unterscheidet weiterhin die α-D-Glucose von der β-D-Glucose. Diese weisen eine unterschiedliche optische Aktivität auf und sind abhängig von der Anordnung der Hydroxygruppe am anomeren Kohlenstoffatom.
In Haworth-Projektion erkennt man eine α-D-Glucose, wenn die Hydroxygruppe am anomeren Kohlenstoffatom nach unten zeigt; zeigt sie nach oben, handelt es sich um eine β-D-Glucose.
Löst man Glucose in Wasser/wässriger Lösung, kann man im Polarimeter zu Beginn eine kontinuierliche Änderung des Drehwinkels beobachten, bis sich irgendwann ein konstanter Wert einstellt. Diese Änderung des Drehwinkels eines optisch aktiven Stoffes bezeichnet man als Mutarotation.
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik