Chemie
- Details
- Zugriffe: 7059
Name: Heller, Henrik, 2023-01
Einleitung
Dieser Artikel beschäftigt sich mit den Fluorchlorkohlenwasserstoffen oder kurz FCKWs. Als Erstes wird geklärt, was diese überhaupt sind, anschließend, welche Eigenschaften sie besitzen, wie sie von den Menschen genutzt wurden und was dies für Auswirkungen auf die Umwelt hat.
Definition
Als FCKWs werden niedermolekulare Kohlenwasserstoffe, bei denen Wasserstoffatome durch die Halogene Chlor, beziehungsweise Fluor, substituiert werden, bezeichnet. Deshalb gehören sie zur Gruppe der Halogenwasserstoffe.
Ein Beispiel ist die Verbindung Trifluormethan, HCF3

Quelle Bild https://commons.wikimedia.org/wiki/File:Trichlorofluoromethane-2D.svg
Beispiel: Trichlorfluormethan
Autor: Benjah-bmm27
Lizenz: public domain
Geschichte und Nutzen für den Menschen
Seit den 1930er Jahren wurden FCKWs synthetisch hergestellt und als Reinigungs- und Lösungsmittel, Kältemittel in Kältemaschinen wie Kühlschränken, in Sprühdosen und in Schaumstoffen verwendet. Fluorchlorkohlenwasserstoffe eignen sich besonders gut für solche Aufgaben, da sie nicht brennbar, geruchlos und ungiftig sind. Zudem besitzen sie einen niedrigen Siedepunkt und lassen sich leicht durch Komprimieren verflüssigen, was das Arbeiten mit ihnen sehr erleichtert.
In den 1970er Jahren wurde dann der Radikalmechanismus entdeckt, in welchem die FCKWs in Radikale überführt werden. FCKWs sind sehr reaktionsträge, weshalb sie 45-100 Jahre in der Atmosphäre der Erde verweilen und sogar bis in die Stratosphäre aufsteigen können, wo sie dann durch die UV-Strahlung der Sonne in die besagten Chlor- und Fluorradikale homolytisch gespalten werden, die dann das Ozon (O3) angreifen und zu Sauerstoff-Molekülen und Chloroxid-Radikalen reagieren. Diese reagieren dann erneut mit Ozonmolekülen, wobei wieder molekularer Sauerstoff und Chlor-Atome entstehen. Das Chlor geht also aus dieser Reaktion unverändert heraus, weshalb man es auch als Katalysator bezeichnet. Ein Chlorradikal kann bis 100000 Ozonmoleküle zerstören, bis es mit einem anderen Radikal oder einem Stickstoffoxid reagiert und somit die Kettenreaktion abgebrochen wird.
Beispielreaktion
Startreaktion

*E = Energie der UV-Strahlung
*Homolytischer Bindungsbruch
Kettenreaktion

Abbruchreaktionen
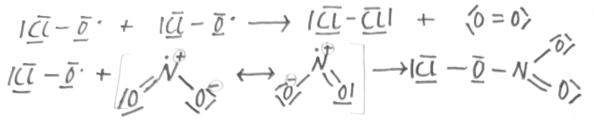
Folgen
Die Ozonlöcher an den Polen der Erde können durch den fehlenden Schutz der Ozonschicht bei Menschen unter anderem Hautkrebs oder Augenverletzungen verursachen.
FCKWs sind aber nicht nur für die Ozonschicht schädlich, sondern tragen auch noch zum anthropogenen Treibhauseffekt bei. Dieser Effekt beschreibt, dass langwellige Sonnenstrahlen von der Sonne durch die Atmosphäre gelangen und von der Erdoberfläche als kurzwellige Sonnenstrahlen reflektiert werden, welche dann von der Atmosphäre auf die Erde zurückgeworfen werden, was durch die FCKWs verstärkt wird.
Dadurch erhitzt sich die Erde im Laufe der Zeit, was schwerwiegende Folgen wie verstärkte Wetterphänomene oder das Durcheinanderbringen des Gleichgewichts von Ökosystemen nach sich zieht.
Nach der Entdeckung des Ozonlochs im Jahr 1985 ist das Montrealer Protokoll in Kraft getreten, in welchem festgehalten wird, dass die Nutzung von FCKWs stark zu reduzieren ist.
Ab dem Jahr 2000 wurde dann die Nutzung von FCKWs zum Schutze der Ozonschicht komplett verboten. Da die FCKWs allerdings mehr als 20 Jahre benötigen, um in die Stratosphäre zu steigen, wurden bereits sehr große Mengen an Fluorchlorkohlenwasserstoffen freigesetzt, bevor die Menschen von den gefährlichen Folgen erfuhren. Seit dem Verbot von FCKWs ist allerdings zu beobachten, dass sich die Ozonschicht an den Polen bereits langsam wieder erholt.
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
