Chemie
- Details
- Zugriffe: 21155
Name: Joseph S., 2023-01
Aldehyde:
Aldehyde sind organische Verbindungen, die von einer Kohlenstoff-Wasserstoff-Gruppe gebildet werden und eine Carbonylgruppe (-C=O) aufweisen. Diese wird als Aldehydgruppe bezeichnet. Die Carbonylgruppe befindet sich an der Endstelle einer Kohlenstoffkette und wird durch die Bindung eines Wasserstoffatoms an das Kohlenstoffatoms und durch die Bindung eines Doppelbindungspartners an das Sauerstoffatom gebildet.
Aldehyde sind in der Regel farblose Flüssigkeiten, die süßlich riechen. Sie kommen häufig in Pflanzen und Tieren vor und spielen auch in der synthetischen Chemie eine wichtige Rolle. Ein bekanntes Beispiel für ein Aldehyd ist Formaldehyd (O=CH2).
Die Oxidation von Aldehyden ist ein chemischer Prozess bei dem die Aldehydgruppe in eine Carboxylgruppe (-COOH) umgewandelt wird. Dies geschieht durch die Zugabe von Sauerstoff und kann mithilfe von Oxidationsmitteln, wie etwa Kaliumpermanganat (KMnO4),durchgeführt werden.
Die Oxidation von Aldehyden kann auch spontan stattfinden, wenn sie sich in Gegenwart von Luft bzw. Sauerstoff befinden. In diesem Fall wird die Aldehydgruppe in eine Carboxylgruppe umgewandelt, was zu einem Anstieg des Sauerstoffgehalts der Verbindung führt.
Aldehyde können von Ketonen durch ihre Oxidierbarkeit unterschieden werden. Die Fehling-Probe und die Tollens-Probe verlaufen mit Aldehyden positiv, mit Ketonen dagegen nicht.
Daraus folgt, dass Ketone im Gegensatz zu Aldehyden keine reduzierende Wirkung besitzen und nicht oxidieren.
Dabei sind drei Proben zum Nachweis von Aldehyden bekannt. Die Fehling-Probe, die Tollens-Probe und die Schiff-Probe:
Die Fehling-Probe:
Die Fehling-Probe wird verwendet, um Aldehyde in Lösungen nachzuweisen. Der Test basiert auf der Tatsache, dass Aldehyde bei der Reaktion mit einer Lösung von Kupfer(II)-sulfat (CuSO4) und einer Kaliumnatriumtartrat-Lösung unter Bindung von Cuproseinen reduziert werden. In der Chemie sind Cuproseine organische Verbindungen, die aus einer Kupfer-Atom Gruppe und einer oder mehreren organischen Gruppen bestehen.
Durchführung:
- Zur Durchführung werden zu Beginn eine Fehling I-Lösung (Kuper(II)-sulfat), die eine hellblaue Farbe besitzt und eine Fehling II-Lösung, welche aus Kaliumnatriumtartrat besteht, das farblos ist, hergestellt. Beide zusammen werden Fehling Lösung genannt.
- Danach wird die zu untersuchende Lösung in ein Probegefäß gegeben und ein Tropfen der Fehling-Lösung hinzugegeben.
- Das Probegefäß wird anschließend über einem Bunsenbrenner erhitzt, bis sich die beiden Lösungen miteinander vermischen.
- Wenn in der Probelösung Aldehyde enthalten sind, werden diese von der Fehling-Lösung reduziert und es bildet sich eine rote Cuproseine-Verbindung. Die Anwesenheit von Cuproseinen (Aldehyden) wird anhand ihrer charakteristischen Farbe, die von rot bis violett reichen kann, nachgewiesen.
Reaktionsgleichung Fehlingprobe:
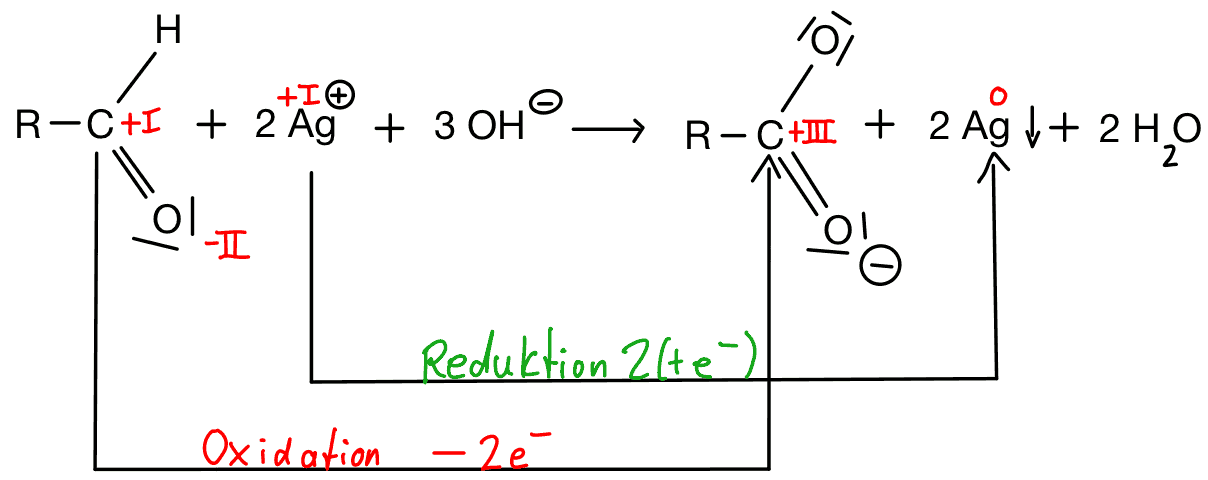
Tollens-Probe (Silberspiegelreaktion):
Die Tollens-Probe, die auch Silberspiegelprobe genannt wird, wird verwendet, um Aldehyde in Lösungen nachzuweisen. Der Test basiert darauf, dass Aldehyde bei der Reaktion mit einer Lösung von Ammoniak (NH3) und Silbernitrat (AgNO3) unter Bildung von Silberamalgam reduziert werden.
Durchführung:
- Für die Durchführung der Tollens-Probe wird zuerst eine Lösung von Ammoniak (NH3) und Silbernitrat (AgNO3) hergestellt. Diese wird auch als Tollens-Lösung bezeichnet.
- Anschließend wird die zu untersuchende Lösung in ein Probegefäß geschüttet und die Tollens-Lösung hinzugegeben.
- Danach werden die beiden Lösungen über einem Bunsenbrenner erhitzt, bis sich die beiden Lösungen vermischen.
- Sind in der Lösung Aldehyde enthalten, werden diese von der Tollens-Lösung reduziert und es bildet sich Silberamalgam. Dieser wird auch als Silberspiegel bezeichnet. Die Anwesenheit von Silberamalgam wird anhand seiner charakteristischen Farbe, die von Grau bis Weiß reichen kann, nachgewiesen.
Reaktionsgleichung Silberspiegelreaktion:
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik