Chemie
- Details
- Zugriffe: 125898
Name: Valentin, 2017-06
Fehlingprobe:
Die Fehlingprobe ist eine Nachweisreaktion für Aldehyde. Die blaue Substanz (bestehend aus Fehling I- und Fehling II-Lösung) färbt sich rot, sobald ein Aldehyd vorliegt. Grund dafür ist, dass die in der Fehling I enthaltenen Kupfer (II)Ionen (Cu2+) zu reinem Kupfer (Cu) reduziert werden und das Aldehyd zur Carbonsäure oxidiert wird. Bei Ketonen funktioniert dieser Nachweis nicht, da diese nicht oxidiert werden können (drohende Fünfbindigkeit des zu oxidierenden Kohlenstoffatoms).
Der genaue Ablauf der Fehlingprobe sowie die passenden Redoxreaktionen dazu findet ihr hier: Fehlingprobe & Tollensreaktion (Tollensprobe)
Reduzierende Wirkung von Zuckern:
Monosaccharide (Einfachzucker):
Viele Zucker liegen als Aldosen vor und haben somit eine reduzierende Wirkung. Der Grund dafür ist, dass die Aldehydgruppe(-COH) zur Carbonsäure oxidiert wird. Obwohl Zucker verhältnismäßig öfter in der Ringform vorliegen, kommt es immer wieder zur Ringöffnung, sodass die Zucker offenkettig vorliegen. In der offenkettigen Form (der Fischerprojektion) liegt dann wieder die funktionelle Aldehydgruppe vor, an der sich der Ring öffnet und schließt (siehe Ringschluss). Somit kann der Reaktionspartner reduziert werden, weshalb man von der reduzierenden Eigenschaft von Zuckern spricht.
Disaccharide (Zweifachzucker):
Auffällig ist, dass die Fehlingprobe bei manchen Disacchariden auch positiv (z.B bei Lactose), aber bei anderen negativ (Saccharose) verläuft. Entscheidend hierfür ist die glycosidische Bindung zwischen den beiden Monosacchariden. Ist eines der beiden anomeren (frei drehbaren) Kohlenstoffe nicht an der glycosidischen Bindung beteiligt, so ist die Ringöffnung und Mutarotation möglich. Somit ist auch die Fehlingprobe bei diesen Zuckern positiv, da die Zucker zu einem gewissen Anteil in der offenkettigen Form vorliegen und die Aldehydgruppe oxidiert werden kann. Sind aber beide anomeren Kohlenstoffatome miteinander glycosidisch verknüpft wie bei der Saccharose, so ist die Ringöffnung der Monosaccharide nicht mehr möglich und die Fehlingprobe reagiert negativ.
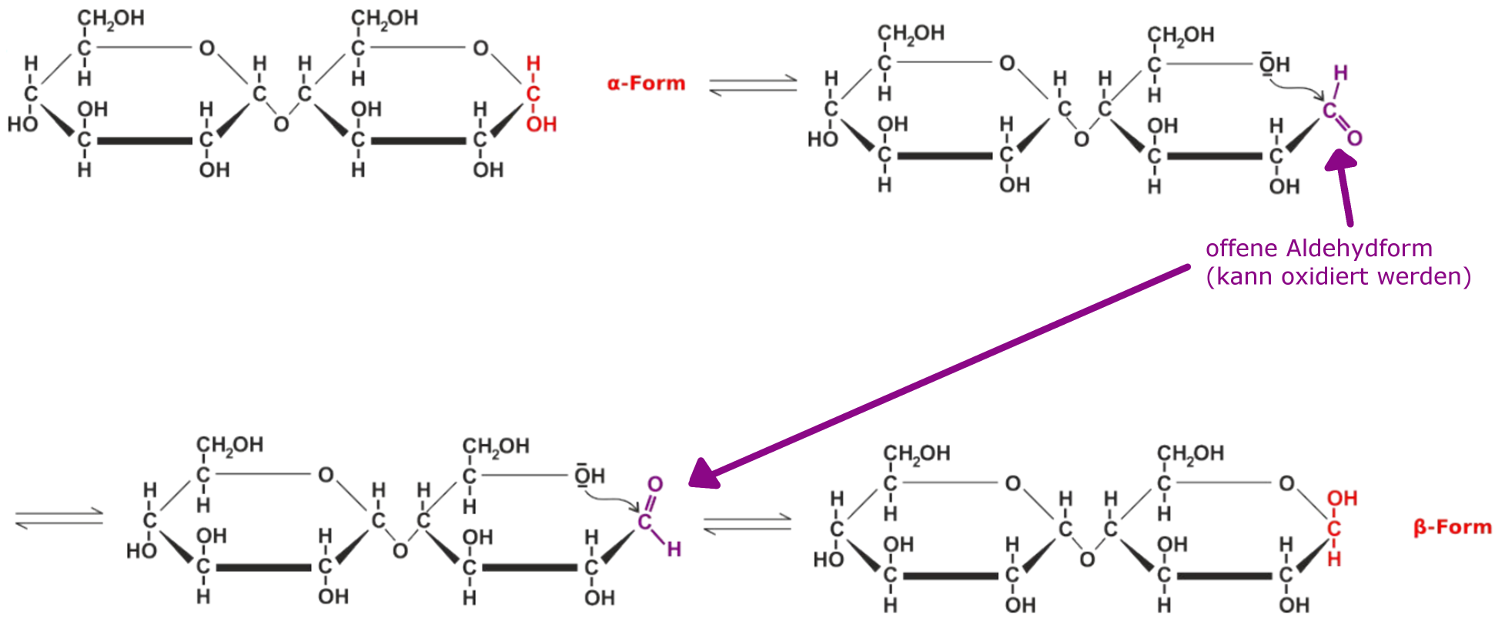
reduzierende Zucker - Mechanismus der Umwandlung
Auf einen Blick reduzierende Zucker erkennen:
Will man lediglich anhand der Stukturformel eines Zuckers einordnen, ob er eine reduzierende Wirkung hat oder nicht, so kann man einem einfachen Schema folgen. Generell kann man sagen, dass alle Monosaccharide eine reduzierende Wirkung haben, da die Ringöffnung möglich ist. Auch alle 1,4-glycosidischen gebundenen Disaccharide haben eine reduzierende Wirkung, da das erste (anomere) Kohlenstoffatom des zweiten Monosaccharids nicht an der glycosidiaschen Bindung beteiligt ist. Zusätzlich hilft uns die Suche nach einem Halb- bzw. Vollacetal. Liegt ein anomeres Kohlenstoffatom vor, so entsteht immer ein Halbacetal (R-C-O-C-OH) und somit ist die Ringöffnung möglich! Damit liegen Aldosen vor, welche leicht reduziert werden können.

Halbacetal
Sind allerdings beide anomeren "C"-Atome miteinander verknüpft, so entsteht ein Vollacetal (R1-C-O-C-O-C-O-C-R2). Dann ist keine Ringöffnung möglich, folglich kann auch kein freies Aldehyd vorliegen und der Zucker hat keine reduktiven Eigenschaften. Eine Fehlingprobe ist dann zum Beispiel negativ!
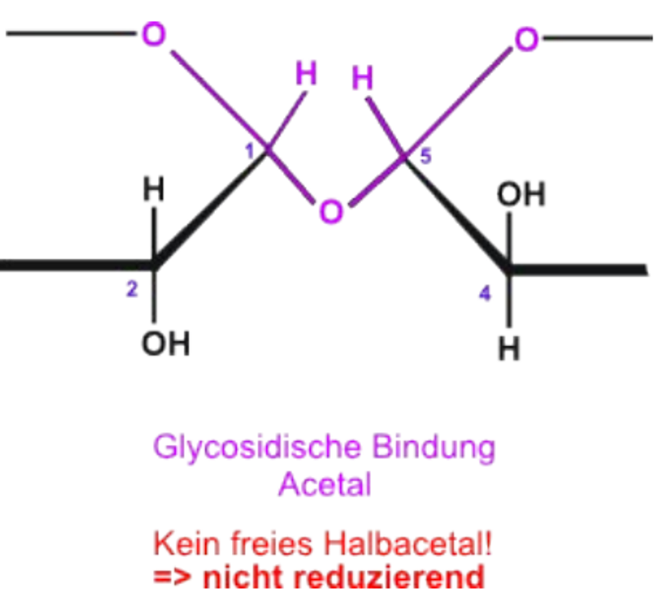
Vollacetal
Schlussfolgerung: Liegt ein bei Kohlenhydraten ein Halbacetal vor, so ist auch ein anomeres Kohlenstoffatom vorhanden und der Zucker ist oxidierbar (bzw. hat eine reduzierende Wirkung). Liegt bei Disacchariden ein Vollacetal vor, so sind die beiden frei drehbaren Kohlenstoffatome miteinander verbunden und können nicht weiter oxidiert werden, weshalb der Zucker in diesem Fall keine reduzierende Wirkung hat.
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
