Chemie
- Details
- Zugriffe: 22809
Name: Valentin Rech, 2016-12
Ethanol
Definiton:
Ethanol ist ein Alkan der alkoholischen Reihe, also ein Ethan mit der einer funktionellen Alkoholgruppe (-OH). Weitergehend hat Ethanol die Summenformel C2H6O und folgende Strukturformel:

Da das Kohlenstoffatom an dem die funktionelle Gruppe gebunden ist nur eine direkte Bindung zu einem weiteren Kohlenstoff besitzt, spricht man von einem primären Alkohol. Das Alkan wird umgangssprachlich auch als Trinkalkohol bezeichnet. Die Bezeichnung mit Vorsilbe Hydroxy-, also Hydroxyethan ist ebenfalls ein korrekter Name für Ethanol.
Eigenschaften:
Ethanol ist bei Raumtemperatur flüssig, farblos und leicht entzündlich. Außerdem hat es den typischen alkoholischen (süßlichen) Geruch und einen brennenden Geschmack. Die Schmelztemperatur liegt mit -114°C deutlich unter der von Wasser, so auch der Siedepunkt bei 78,32°C.
Verwendung:
Alkohol ist ein Lebergift und gilt somit als Droge. Daher wird es zur Herstellung von bekannten, alkoholischen Genussmitteln genutzt (z.B. Bier, Wein). Allerdings ist er auch in Konsumprodukten, wie in Deos oder Parfüms zu finden. In der Medizin ist er ein Lösungsmittel in Medikamenten oder auch in Desinfektionsmittel. Sowie in der Industrie wo er ebenfalls als Lösungsmittel und generell als Brennstoff fungiert.
Herstellung:
Zur Herstellung von Alkoholen gibt es grundsätzlich 2. Möglichkeiten:
Die erste Möglichkeit ist die Alkoholische Gärung. Diese läuft ab, sobald Hefe in einem Gefäß mit Biomasse (bei Herstellung von Genussmitteln meist Säfte aus Feldfrüchten) und wenig Sauerstoff gegeben wird. Die Gärung läuft dann bis zu einer Alkoholkonzentration von 15% automatisch ab, danach sterben die Hefezellen aufgrund der hohen Konzentration des Zellgifts (=Alkohol) ab.
Die zweite Möglichkeit ist die elektrophile Addition genannt, diese erfolgt durch die heterolytische Spaltung von Ethen und dem anschließenden Einbinden von Wasser(H2O). Sie läuft in 5 Schritten ab: 1. Die heterolytische Spaltung von Wasser. Hier werden durch eine kurze Bestrahlung mit Licht kurzzeitige Dipole bei Wasser ausgelöst. 2. Darauf wird das kurzzeitig positiv geladene Wasserstoffatom des Wassers von der Doppelbindung des Ethens angezogen. 3. Es kommt zum sogenannten π-Komplex(Pi-Komplex), ein Übergangskomplex, bei dem sich die Doppelbindung aufspaltet. 4. Im fließenden Übergang wird dann das Wasserstoffatom mit einer festen Bindung an einen der beiden Kohlenstoffe gebunden. 5. Da nun der andere Kohlenstoff nur dreibindig und somit positiv geladen ist, wird das negativ geladene Hydroxidion vom positiv geladenen Kohlenstoff angezogen und bindet sich mit diesem. Es ist Ethanol entstanden.
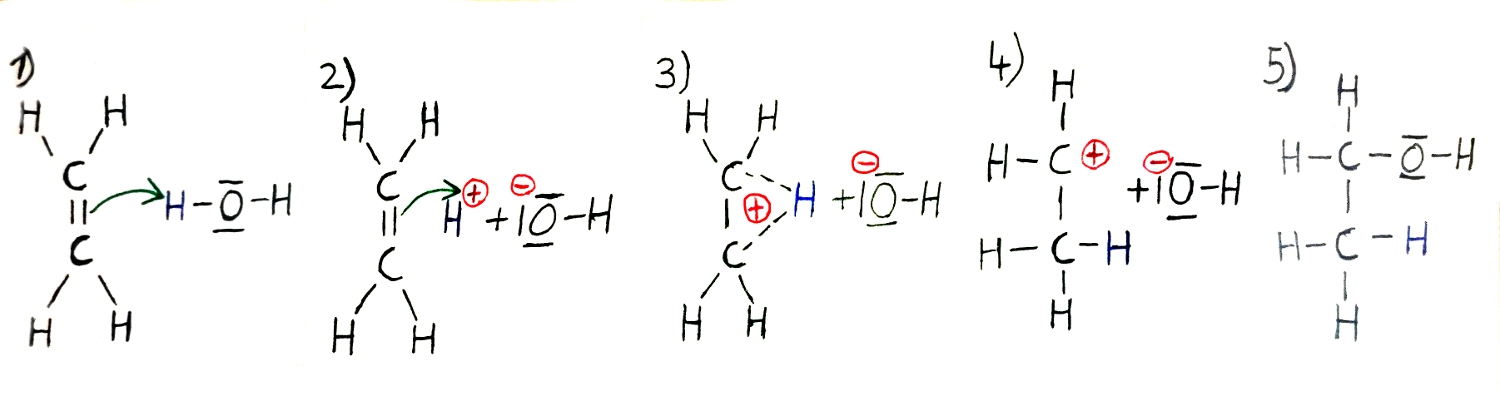
Allerdings kann bei beiden Vorgängen höchstens ein primärer Alkohol entstehen(der bindende Kohlenstoff zur Alkoholgruppe hat nur zu einem weiteren Kohlenstoff eine Elektronenbindung). Das liegt daran, dass Ethanol nur zwei Kohlenstoffatome besitzt.
Abbau:
Der Abbau von Alkohol läuft in drei Schritten ab, dabei wird der Ausgangsstoff mehrmals oxidiert. Ethanol wird zu einem noch giftigeren Zellgift mit dem Namen Acetaldehyd(C2H4O) oxidiert, welches dann zu Essigsäure(C2H4O2)oxidiert wird. Essigsäure oxidiert dann im letzten Schritt zu unschädlichem Wasser(H2O) und Kohlenstoff(CO2).
Auswirkungen:
Der Alkohol ist auf heutigen Events nicht mehr weg zu denken, die Gründe für den Konsum sind dabei unterschiedlich. Oft wird er wegen seinem Geschmack oder dem darauf folgenden "Rausch" getrunken, der die Stimmung heben soll. Häufiger Alkoholkonsum kann allerdings eine Vielzahl an Schäden im Körper hervorrufen. Neben Schleimhaut- oder Bauchspeicheldrüsenentzündungen, Leberzirrhose und Vitaminmangel kann Alkohol sogar das Krebsrisiko um ein vielfaches steigern. Während beim Konsumenten oft nur Kopfschmerzen offensichtlich werden, schädigt der Alkohol Muskeln und Nervenbahnen.
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
