Chemie
- Details
- Zugriffe: 43164
Name: Kevin Hajok, 2017-01
Erdöldestillation zur Gewinnung von Kohlenstoffenwasserstoffen
Prinzip des Verfahrens
Zunächst wird das gewonnene Erdöl noch an den Lagerstätten aufbereitet, indem unerwünschte Bestandteile (Sedimente und Wasser) getrennt werden. Danach werden die einzelnen Bestandteile des Rohöls in einer Raffinerie mithilfe Destillationsverfahren getrennt und für den Verkauf aufbereitet. Durch die fortgeschrittene Technik heutzutage kann jeder Bestandteil des Rohöls verwendet werden.
1. Schritt: Erdölreinigung/Entsalzung
Zu Beginn wird an der Lagerstätten das Rohöl entsalzt, indem unter Zugabe von Wasser eine Rohöl-Wasser-Emulsion entsteht. Während dieser wässrigen Phase löst sich das Salz. In einem elektrostatischen Entsalzer wird das Gemisch bei Temperaturen von ca. 130°C wieder getrennt, sodass sich das salzhaltige Wasser am Boden absetzt. Jetzt kann das entsalzte Rohöl zum nächsten Schritt, der Rohöldestillation, gepumpt werden. Um zu verhindern, dass leichtflüchtige Bestandteile entweichen, erfolgt die Entsalzung bei erhöhtem Druck. Eine weitere Möglichkeit des Aufbrechens dieses Öl-Wasser-Gemischs ist die Zugabe von Chemikalien, etwa von Demulsifier.
2. Schritt: Rohöldestillation
Bei der Destillation muss das Rohöl zunächst in Wärmetauschern mithilfe Wärmerückgewinnung des ablaufenden Produkts vorgewärmt werden. Danach spielt sich die Spitzenvorheizung in Röhrenöfen auf ca. 400°C ab.
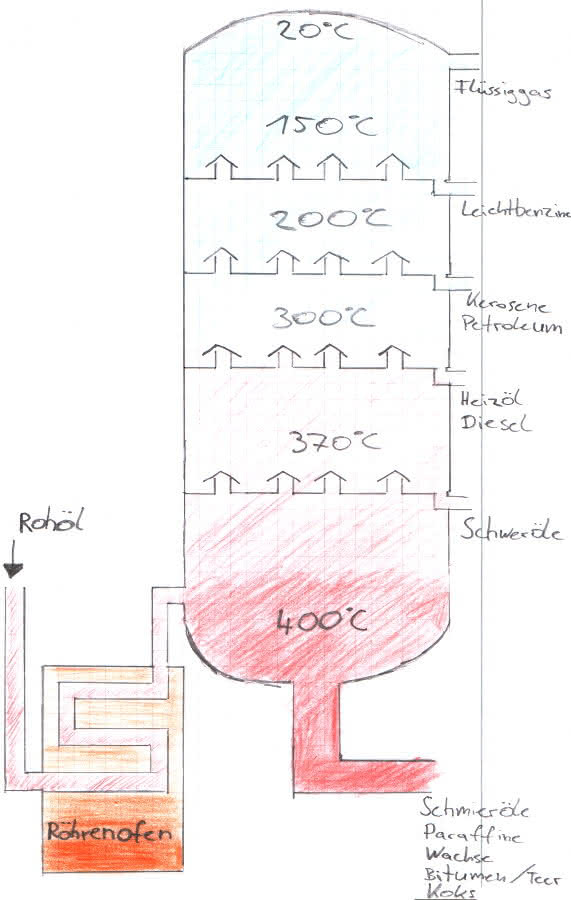
Nun kann das vorgewärmte Rohöl durch das Verfahren der Rektifikation in einer Kolonne in seine Komponenten aufgeteilt werden. Dabei wird Rohöl in sowohl gasförmigem als auch flüssigem Zustand in die Kolonne geleitet. Die 50 m hohe Kolonne kann man nun in verschiedene Abschnitte einteilen, wobei die Temperatur von unten (vom Sumpf) nach oben (zum Kopf) sinkt. Durch die niedrigen Siedepunkte der leichten Bestandteile des Rohöls sind diese nicht in der Lage im Sumpf zu kondensieren und steigen gasförmig nach oben. Dabei treffen die Gase auf Einbauten (Glockenböden oder Ventilböden), in denen sich die Destillate der einzelnen Bestandteile befinden.
Die flüssigen Destillate und das Gas werden in Kontakt gebracht, wobei es zu einem Stoff- und Energieaustausch kommt. Nun können einige Bestandteile wiederrum kondensieren und andere steigen weiter in gasförmigem Zustand auf. Somit entsteht die Trennung dieser Stoffe. Damit ist auch klar, dass die Siedepunkte der Bestandteile im Sumpf am höchsten und am Kopf am niedrigsten sind. Des Weiteren ist zu erwähnen, dass am Kopf der Kolonne ein Gasstrom (meistens Flüssiggas und Benzin) abgezogen und dann mithilfe eines Liebigkühlers abgekühlt wird und das Gas so kondensiert. Dieses Produkt kann man nun weiter aufbereiten oder der Kolonne wieder hinzufügen.
Im Sumpf der Kolonne werden die Rückstände zu einer weiteren Destillationskolonne geführt und mithilfe einer Vakuumdestillation bei niedrigem Druck in die einzelnen Bestandteile getrennt. Durch den niedrigen Druck werden die Siedepunkte verringert, wodurch eine weitere Destillation erst möglich wird, da bei normalem Druck und hohen Temperaturen viele Kohlenwasserstoffe zerfallen würden.
3. Schritt: Konservierungsverfahren und Blending
Hydrotreating
Die einzelnen Komponenten aus der Destillationskolonne besitzen noch viele Schwefelverbindungen. Bei einer weiteren Verarbeitung würden diese Schwefelverbindungen Schwefeldioxid freisetzen, weswegen bei diesem Verfahren die Bestandteile mit den Schwefelverbindungen mit Wasserstoff vermischt und auf über 300°C erhitzt werden. Dieses Gemisch wird in einen Reaktor, welcher mit Katalysatoren gefüllt ist, geführt und dabei reagiert der Wasserstoff mit den Schwefelverbindungen zu Schwefelwasserstoff:
R-SH + H2 --> R-H + H2S
Die dabei entstandenen hohen Mengen H2S können nicht einfach verbrannt werden. Deswegen werden sie mit Luftsauerstoff in einem Reaktor verbrannt, wobei das dabei entstandene SO2 mit restlichem H2S zu Schwefel und Wasser reagiert.
6H2S + 3O2 --> 6S + 6 H2O
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
