Chemie
- Details
- Zugriffe: 40819
Name: Michel Engelke, 2017-01
Kevin Keller, 2021-02
Definition
Als Eliminierungsreaktion werden in der organischen Chemie Reaktionen bezeichnet, bei welchen zwei Atome/Atomgruppen aus einem Molekül abgespalten werden. Damit diese Reaktion gelingt, müssen zwei Bindungen aufgebrochen werden.
Die Eliminierung ist die Umkehrreaktion der Addition und eine Konkurrenzreaktion zur nukleophilen Substitution. Dehydratisierung (Entfernung von Wasser) sowie Dehydrohalogenierung sind die beiden elementarsten Eliminierungen.
Arten der Eliminierung
- α-Eliminierung (1,1-Eliminierung): Eliminierung findet an einem einzelnen C-Atom statt. Dabei wird ein instabiles (konstante Umwandlung in geringeren freien Energiegehalt) Carben gebildet, das augenblicklich weiter reagiert
- β-Eliminierung (1,2-Eliminierung): An zwei benachbarten C-Atomen findet die Eliminierung statt, wobei es zu einer Doppel- oder Dreifachbindung kommt. Diese Form der Eliminierung kommt am häufigsten vor.
- γ-Eliminierung (1,3-Eliminierung): Eliminierung findet an zwei nicht direkt benachbarten C-Atomen statt, woraus sich ein dreigliedriger Ring bildet.
Unterschiedliche Reaktionsmechanismen bei der Eleminierung:
Abhängig von der Aktivierungsenergie und der Reaktionsgeschwindigkeit können unterschiedliche Reaktionsmechanismen ablaufen, die in E1 und E2 eingeteilt werden. Welche der beiden Eliminierungen eintritt, lässt sich durch die Reaktionsbedingungen feststellen. Dazu zählen Temperatur, Lösungsmittel, Substrat sowie das angreifende Teilchen.
Eliminierung - E1:
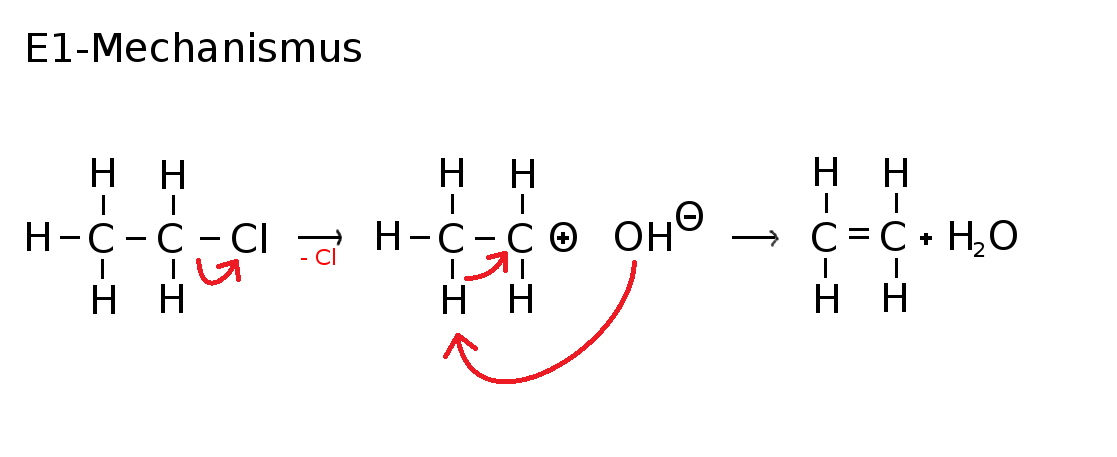
Hierbei handelt es sich um eine monomolekulare Reaktion, das bedeutet, die Reaktionszeit ist nur von der Konzentration eines Ausgangsstoffes abhängig. Überdies ist E1 eine Stufenreaktion; die einzelnen Atome lösen sich in zwei Schritten nacheinander. Bei der oben erwähnten Dehydratisierung liegt ein E1-Mechanismus vor. (Bild 2)
1. Man besitzt ein Alkan.
2. Zuerst wird die Abgangsgruppe (in diesem Fall das Brom) unter Bildung eines Carbeniumions abgespalten.
3. Nun greift eine Base ein Proton am benachbarten C-Atom an, wobei jene C-H-Bindung aufgelöst und eine Doppelbindung zwischen den beiden C-Atomen gebildet wird.
4. Ein Alken ist entstanden.

Eliminierung - E2:
Es handelt sich um eine bimolekulare Reaktion, das bedeutet, die Reaktionszeit ist von der Konzentration von zwei Ausgangsstoffen abhängig. E2 ist eine Synchronreaktion; dort lösen sich die einzelnen Atome simultan und somit in einem Schritt. Bei der eingangs erwähnten Dehydrohalogenierung liegt ein E2-Mechanismus vor.
Des Weiteren gibt es noch den E1cb-Mechanismus. Dieser ist E1 ziemlich ähnlich und unterscheidet sich davon primär in der Reihenfolge. Bei E1 wird zuerst die Abgangsgruppe eliminiert, bei E1cb vorher noch das Proton. Der E1cb-Mechanismus wird bei der basenkatalysierten Aldolkondensation angewandt. (Bild 3)
1. Man besitzt ein Alkan.
2. Die Abgangsgruppe (in diesem Fall das Brom) spaltet sich zeitgleich zum Wasserstoff, welches sich an eine Base bindet, vom Alkan ab. Es entsteht eine Doppelbindung zwischen den beiden C-Atomen.
3. Ein Alken ist entstanden.

Begünstigende Bedingungen:
Eliminierung - E1:
-ein stabilisiertes Kation existiert (Lösungsmittel ist polar-protisch, I-Effekt)
-hohe Temperatur (erhöhte Abspaltungswahrscheinlichkeit)
-schwache Basen
Eliminierung - E2:
-niedrige Temperatur
-starke Basen
-Kation kann nicht gut isoliert werden (polar-aprotisches Lösungsmittel)
Eigenschaften:
Eliminierung - E1:
-monomolekulare Reaktion (Angriff und Spaltung zeitversetzt)
-Reaktion besteht aus mehreren Stufen, in welchen ein Carbeniumion gebildet wird (isolierbare Zwischenstufe)
-Reaktionsgeschwindigkeit ist nur von der Konzentration des Substrats abhängig
Eliminierung - E2:
-bimolekulare Reaktion (gleichzeitiger Ablauf von Angriff und Spaltung)
-kein isolierbarer Übergangszustand
-Reaktionsgeschwindigkeit ist von der Konzentration des Substrats und der Base
Säurekatalysierte Dehydratisierung von Alkoholen (Eliminierung von Wasser aus Alkoholen)
Wie oben erwähnt, zählt die Dehydratisierung zu den elementarsten Eliminierungen. In diesem Falle bedeutet dies, dass in einer Eliminierungsreaktion Wassermoleküle von Alkoholmolekülen abgespalten werden. Hierbei entstehen Alkenmoleküle. Als Katalysator dient eine starke Säure. So wird beispielsweise aus Propanol mithilfe von Schwefelsäure Propen gebildet.
Vergleich zur nukleophilen Substitution
Die Eliminierung wird als Konkurrenzreaktion zur nukleophilen Substitution gesehen. So wird E1 gegenüber der SN1-Reaktion beispielsweise bei der Anbindung vieler Alkylgruppen, geringer Nukleophilie sowie einer Temperaturerhöhung bevorzugt. E2 wird gegenüber der SN2-Reaktion beispielsweise bei der Verwendung einer besonders starken Base oder stärker unpolarer Lösungsmittel bevorzugt.
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik