Chemie
- Details
- Zugriffe: 15031
Name: Joshua Möller, 2020-12
Man kann organische Verbindungen auf vielerlei Weisen Darstellen, dabei gibt es keine perfekte, einzige Darstellungsweise, da jede Art ihre eigenen Vor- und Nachteile hat.
1. Summenformel (Molekülformel):
Die Molekülformel oder Summenformel gibt an, aus welchen Atomen das Molekül besteht, was durch die Abkürzung aus dem Periodensystem der Elemente angezeigt wird, und ihre Anzahl, was durch die tiefergestellte Zahl gezeigt wird.
Beispiel (n-Pentan):
C5H12
2. Strukturformel:
Die Strukturformel entspricht der Lewis-Formel. Sie zeigt alle Atome in Form mit ihrem Symbol aus dem Periodensystem der Elemente und alle bindenden und freien Elektronenpaare des Moleküls, welche mit Strichen und in manchen Fällen auch mit Punkten verdeutlicht werden. Die zusammen verknüpften Atome werden dargestellt. DIese Darstellungsweise wird auch Valenzstrichformel genannt.
Beispiel (n-Pentan):
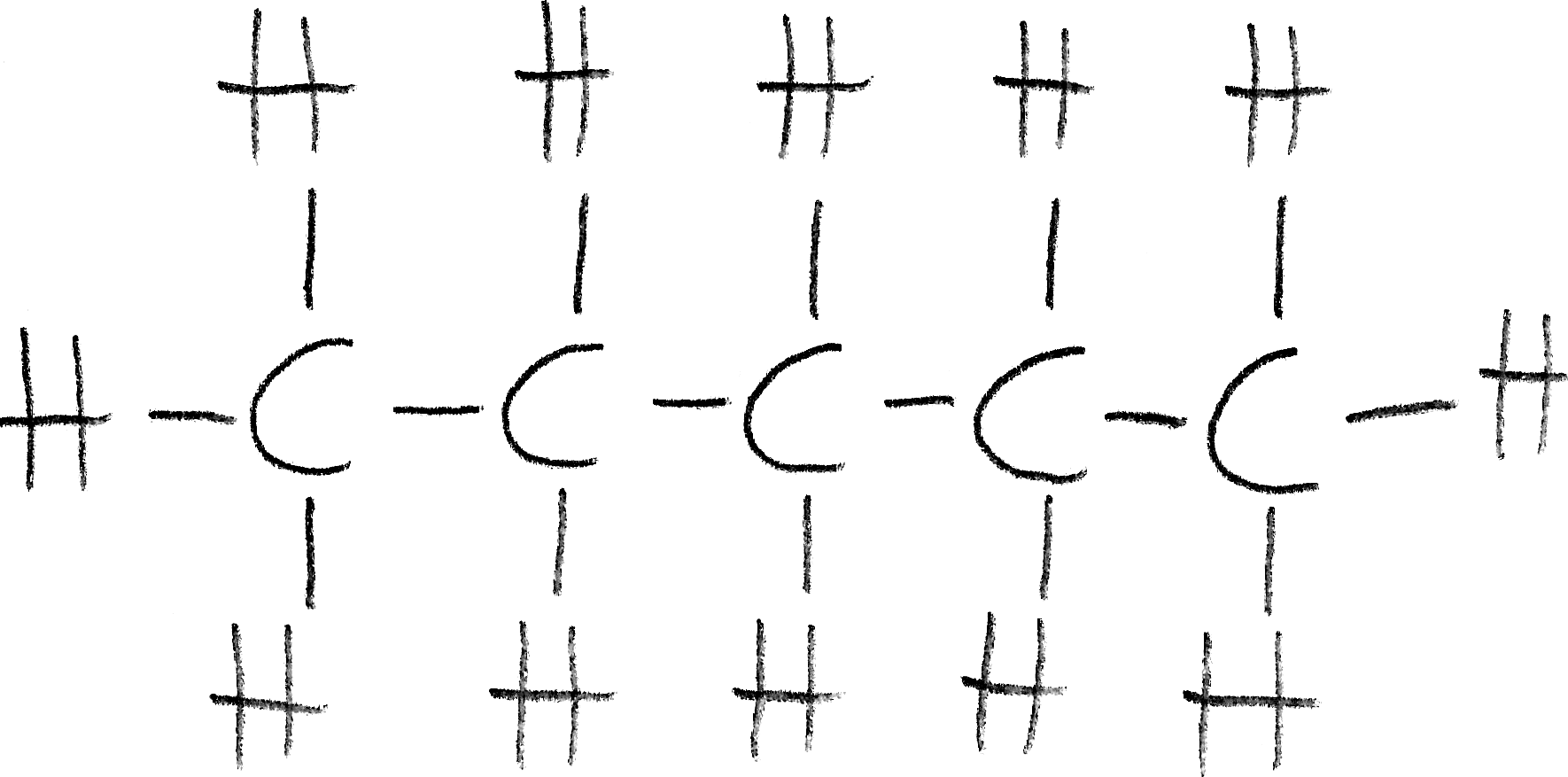
Strukturformel Pentan
3. Halbstrukturformel:
Sie wird auch vereinfachte Strukturformel genannt und zeigt die Anordnung der Kohlenstoffatome und die zwischen ihnen gebundenen Elektronenpaare in Form von Strichen. Des Weiteren zeigt sie die an die Kohlenstoffatome gebundenen Wasserstoffatome im Molekül und ihre Anzahl, welche die tiefergestellte Zahl angibt. Der Hauptunterschied zur Strukturformel ist der, dass sie nur die bindenden Elektronenpaare zwischen den Kohlenstoffatomen anzeigt und nicht die zwischen den Kohlenstoff- und Wasserstoffatomen.
Beispiel (n-Pentan):
H3C-CH2-CH2-CH2-CH3
4. Keil-Strich-Formel:
Mit dieser Formel wird die räumliche Anordnung der Atome im Molekül deutlich gemacht. Betrachtet man die vier Bindungen eines Kohlenstoffatoms, so liegen, räumlich gesehen, zwei Bindungen auf einer Ebene mit dem Kohlenstoffatom, während jeweils eine Bindung vor und hinter dem Kohlenstoffatom liegen. Die Bindungen auf der Ebene der Kohlenstoffatome werden durch einfache Striche dargestellt. Für die aus der Ebene nach vorne ragenden Bindungen wird ein ausgemaltes Dreieck verwendet, für die aus der Ebene nach hinten ragenden Bindungen ein gestricheltes Dreieck.
Beispiel (n-Pentan):
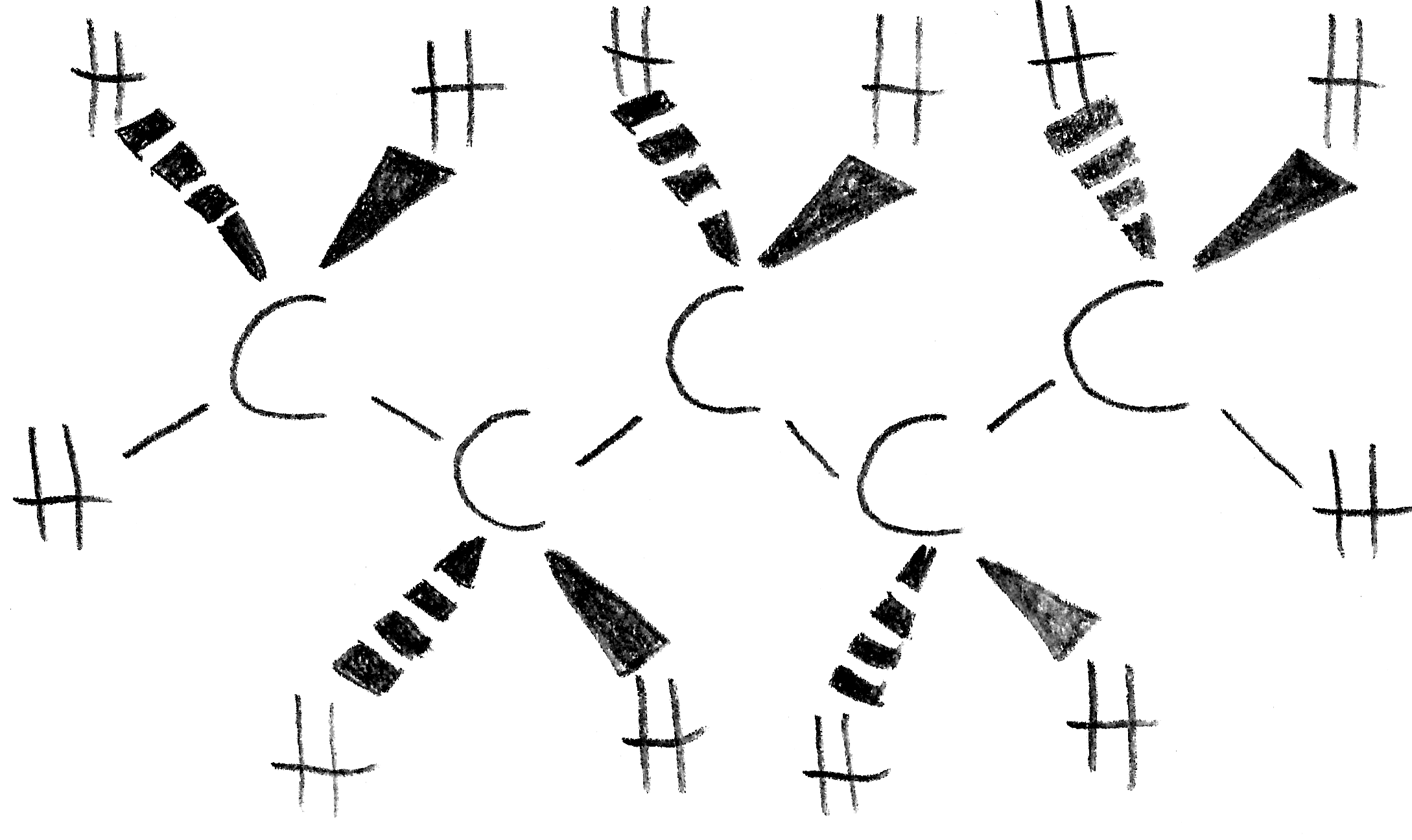
Keilstrichformel von Pentan
5. Skelettformel:
Die Skelettformel zeigt die Kohlenstoffkette als eine gewinkelte Linie, an deren Knickpunkte sich CH2-Gruppen und an deren Enden sich CH3-Gruppen befinden. Wasserstoffatome sowie die C-H-Bindungen werden weggelassen. Gegebenenfalls im Molekül enthaltene funktionale Gruppen werden an ihrem Bindungsort explizit ausgewiesen. Heteroatome werden hingegen mit ihrer Bindung eingezeichnet.
Beispiel:
![]()
Skelettformel von Pentan
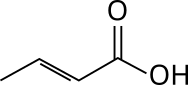
Skelettformel von Pentensäure
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
