Chemie
- Details
- Zugriffe: 12785
Name: Cornelius Zimmermann, 2023-01 (Instagram: @coornellius)
Alkoholische Gärung:
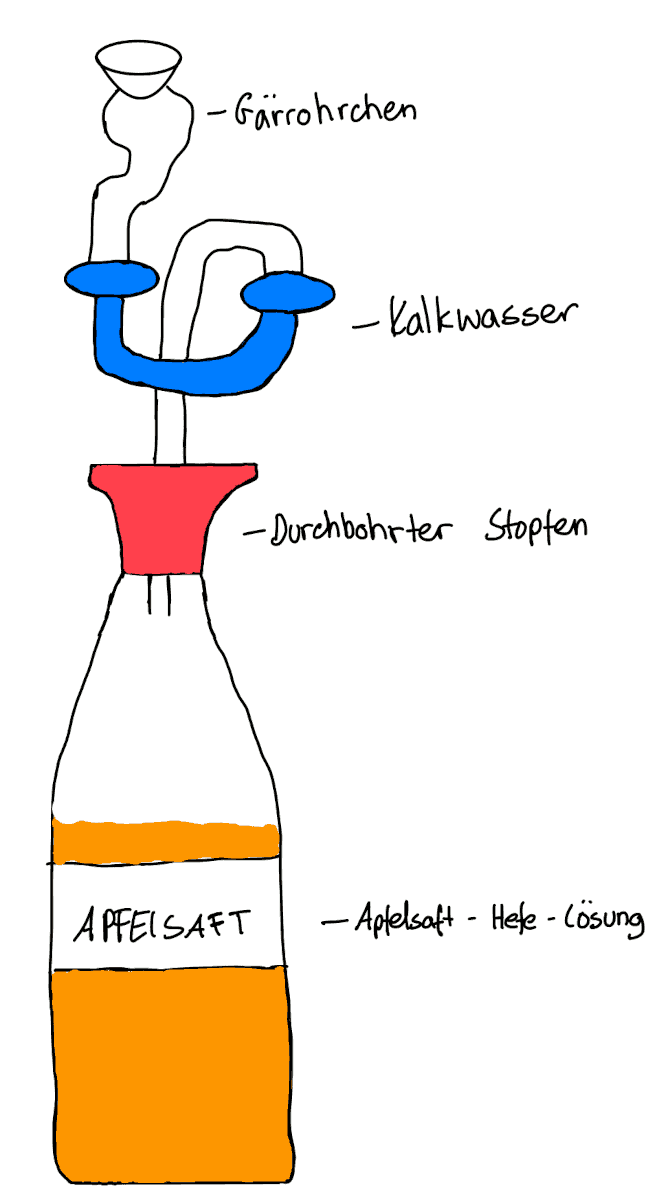
Bei der alkoholischen Gärung reagiert Zucker unter Wirkung von Hefe (Enzymen) zu Ethanol und Wasser.
In der Natur sind Hefepilze auf den Schalen von den Früchten und gären dort.
Material: frische Hefe, Apfelsaft, Stopfen, Gärröhrchen
Durchführung:
1. Apfelsaft öffnen und Deckel beiseite legen
2. Zwei Spatelspitzen Trockenhefe zum Apfelsaft dazu geben
3. Kalkwasser in das Gärröhrchen geben
4. Apfelsaftflasche mit durchbohrten Gummistopfen mit Gärröhrchen verschließen
Beobachtung:
• Die Flüssigkeit wurde trüb/milchig → Apfelsaft ist dunkler geworden
• Die Lösung fängt an zu blubbern
• Es bildeten sich kleine Flocken im Gärröhrchen und einen Bodenbelag in der Flasche
• Nach ein paar Tagen riecht die Lösung leicht alkoholisch
Auswertung:
• Hefe dient in der Lösung als Katalysator
• setzt die Aktivierungsenergie ab
• erhöht die Reaktionsgeschwindigkeit
• liegt nach der Reaktion unverändert vor
Der Fruchtsaft gärt zu Ethanol, Kohlenstoffdioxid entsteht (Mögliche Erweiterung: Trübung des Kalkwasser ist Nachweis für das entstehende Kohlenstoffdioxid)
Reaktionsgleichung:
C6H12O6 + Hefe→ 2 C2H5OH +2 CO2
Alkoholische Destillation:

Destillation: Stofftrennverfahren
Die Destillation ist ein Trennverfahren, welches durch Verdampfen und anschließender Kondensation stattfindet.
Aufgrund der unterschiedlichen Siedetemperaturen können Ethanol und Wasser durch Destillation voneinander getrennt werden.
Material: Stativ, Heizpilz, Rundkolben, Thermometer, Liebigkühler, Becherglas, gegärter Alkohlo
.
Durchführung:
1. Destillationsapparatur aufbauen
2. Den Rundkolben mit Hilfe eines Trichters mit dem Apfelwein (halbvoll) befüllen.
3. Rundkolben verschließen, Thermometer aufsetzten und Heizpilze sowie Liebigkühler anstellen
4. Temperaturänderungen im Rundkolben alle 30sek. protokollieren. Auf die Kondensationsvorgänge im Kolben und auch in der Destillierbrücke achten.
5. In einem Becherglas das Destillat bei ca. 78C auffangen → steigt die Temperatur sollte man ein zweites Becherglas verwenden.
6. Destillation beenden, wenn noch Flüssigkeit im Rundkolben vorhanden ist (Gefahr des Einbrennes der Destillationsreste)
Beobachtung:
• Destillat ist farblos und riecht alkoholisch
• Hingegen vor der Reaktion ist das Destillat nun brennbar
Auswertung:
Aufgrund der unterschiedlichen Siedetemperaturen von Ethanol (sdp. 78°C) und Wasser (sdp.100°C) kann das Stoffgemisch durch eine Destillation getrennt werden. Anhand der Brennprobe, kann nachgewiesen werden, das Ethanol abdestilliert wurde. Ethanol brennt mit blauer Flamme und weist einen süßlichen Geruch auf.
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
