Chemie
- Details
- Zugriffe: 14784
Name: Kaffo, Naomie 2022-03
Defintion von Biokatalysatoren:
Biokatalysatoren sind Enzyme, die in ihrer Form Biopolymere ähneln. Sie beschleunigen biochemische Prozesse. Dies geschieht durch die Herabsetzung der Aktivierungsenergie. Auch wenn der Biokatalysator an der Reaktion beteiligt ist, geht er unverändert aus der Reaktion und kann auf diese Weise an vielen Reaktionszyklen hintereinander mitwirken.
Biokatalysatoren sind an Prozesse der Zellerneuerung, der Blutgerinnung, der Verdauung und der Herstellung von Wein und weitere andere beteiligt.
Aufbau von Biokatalysatoren
Jedes Enzym besitzt ein aktives Zentrum durch die Auffaltung der Tertiärstruktur. Das aktive Zentrum hat eine charakteristische Raumstruktur. Die Aminosäure-Bausteine, die sich im aktiven Zentrum befinden, sind in der Lage über ihre Seitenketten mit Molekülen, bei denen die Raumstruktur und die Polarität passen, eine Bindung einzugehen. Diese Moleküle werden als Substrate bezeichnet. Substrate weisen eine komplementäre Raumstruktur zum aktiven Zentrum auf. Außerdem wird ihre Reaktion von Enzymen katalysiert. Aufgrund ihres Aufbau sind Enzyme substrat- und wirkungsspezifisch. Was das genau bedeuten soll, wird im Folgenden erklärt.
Wirkungs-und Substratspezifität bei Enzymen
Der Großteil der Enzyme (Biokatalysatoren) sind Proteine mit einer dreidimensionalen Struktur. Im Vergleich zu anderen Katalysatoren, sind Enzyme in der Lage die Aktivierungsenergie soweit herab zu setzen, dass Reaktionen schon bei Körperwärme schnell ablaufen. Bei Temperaturen, die jedoch das Temperaturoptimum eines Enzyms überschreiten, denaturieren die Enzyme und ihre Aktivität geht mit der Zerstörung ihrer Struktur durch die Denaturierung verloren.
Enzyme sind spezifisch. Ihre Spezifität bezieht sich zum einen auf die Substrate deren Umsetzung sie katalysieren müssen, zum andern katalysieren sie nur bestimmte Reaktionstypen. Diese beiden Eigenschaften nennt man Substrat- und Wirkungsspezifität.
Wirkungsspezifische Enzyme haben eine hohe Kopplung an bestimmte Reaktionstypen. Daher können sie nicht jede Reaktion katalysieren. Abhängig von der Zusammensetzung der Aminosäure-Bausteine im aktiven Zentrum wird über die Reaktion entschieden durch die das Substrat umgesetzt werden soll. Hier erfolgt die Erkennung der Reaktion durch bestimmte Eigenschaften des aktiven Zentrums. Diese Enzyme katalysieren aber nicht nur ein Substrat, sie verfügen über die Fähigkeit mehrere Substrate zu katalysieren, da sie nicht substratspezifisch sind.
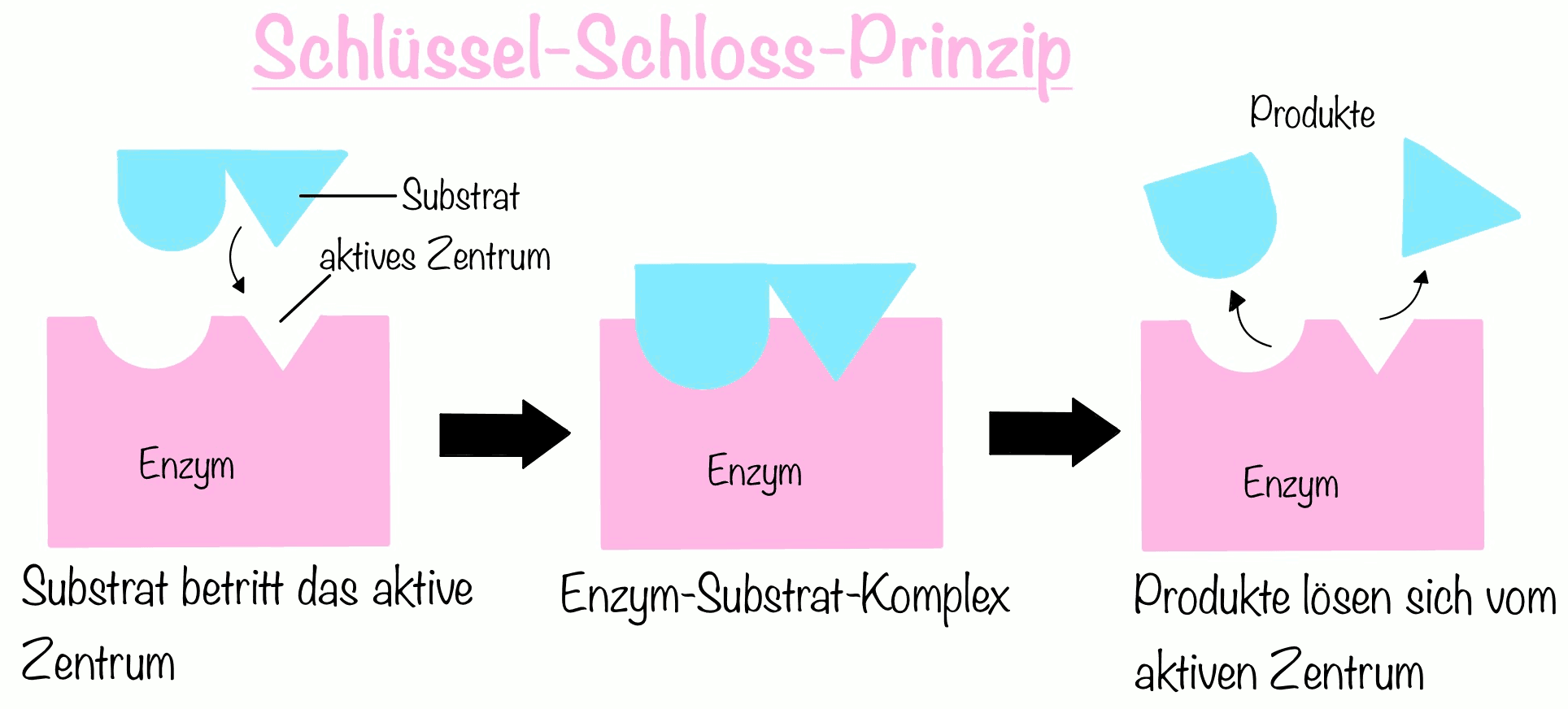
Substratspezifische Enzyme können nur an ganz bestimmten Substrate anlagern. Die Wechselwirkungen zwischen Substrate und Enzyme erfolgen über Wasserstoffbrücken, Ionenbindungen und Van-der-Waals-Kräfte. Die Substraterkennung bzw. Substratanlagerung geht nach dem Modell des Schlüssel-Schlosses vonstatten. Diese Substratanlagerung wird das Enzym-Substrat-Komplex genannt.
Das Schlüssel-Schloss-Prinzip besagt, dass die Form des aktiven Zentrum schon vorliegt, bevor das Substrat daran bindet. Auf diese Art erfolgt die Substratanlagerung aufgrund der komplementären Gestalten des aktiven Zentrums mit dem Substrat. Also müssen Enzym und Substrat miteinander passen wie ein Schlüssel zum Schloss, wenn dies nicht der Fall ist, kann das Enzym nicht am Substrat anlagern.
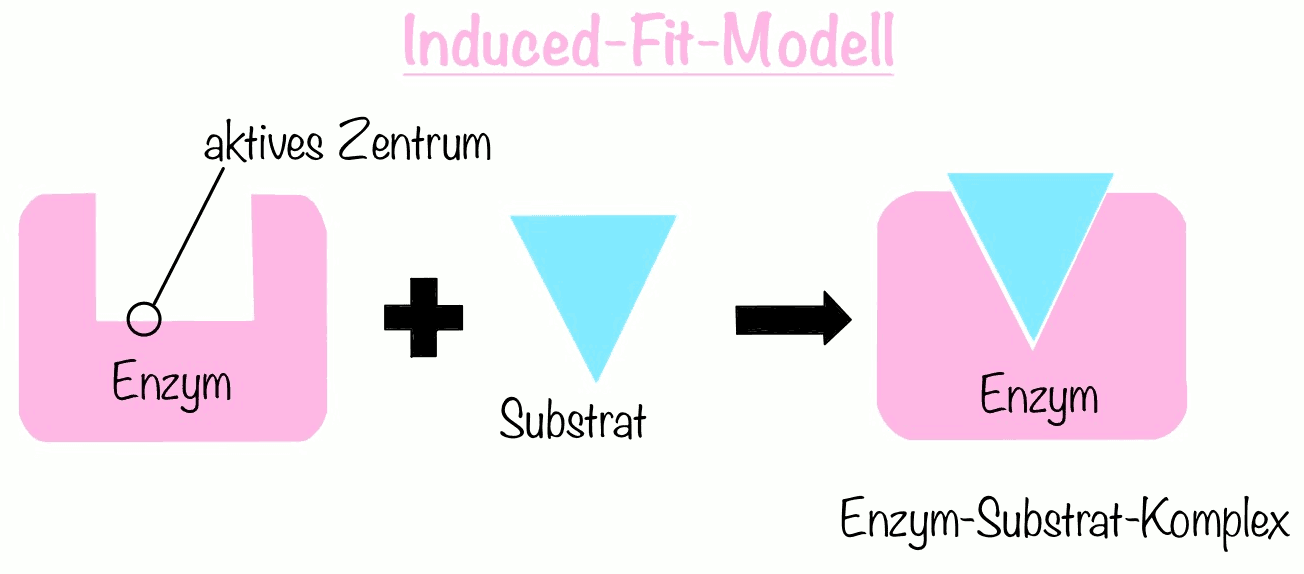
Das Modell der induzierten Anpassung (Induced-fit-Modell) verfeinerte jedoch das Schlüssel-Schloss-Prinzip im Jahre 1959. Die Raumstruktur des aktiven Zentrums wird erst durch die Bindung des Substrats verändert (also passend gemacht) und liegt nicht schon vorher vor. Dies bedeutet, Dass die komplementären Strukturen zwischen Enzym und Substrat erst im Enzym-Substrat-Komplex.
Funktion von Biokatalysatoren
die Funktionsweise der Enzyme ist mit die anderen Katalysatoren gleich zu stelle. Sie katalysieren die Reaktionen. Mithilfe des aktiven Zentrums kann das Substrat, welches an einen Biokatalysator gebunden ist, umgesetzt werden. Die Umsetzung des Substrat kann verschieden stattfinden, jedoch ist die Möglichkeit des aktiven Zentrums beim Katalysieren von der Art des Enzyms abhängig.
Nach der Reaktion liegt der Biokatalysator unverändert vor. Die Funktionsfähigkeit des Biokatalysators kann durch unterschiedlichen Faktoren wie Temperatur, Hemmstoffe, Säuren, Basen etc. verändert werden. Ein Beispiel dafür wäre die Reaktionsgeschwindigkeit-Temperatur-Regel (RGT-Regel), die den Einfluss von Temperatur auf die Funktion von Enzymen bzw. auf die Enzymreaktionen beschreibt. Was aber ist diese RGT-Regel?
Reaktionsgeschwindigkeit-Temperatur-Regel
Enzyme bevorzugen bestimmte pH-Werte und Temperaturbereiche bei denen sie katalytisch am besten wirksam sind. Die Enzymaktivität geht bei hohen Temperaturen und in stark saurer oder stark alkalischen Lösungen verloren, weil die Tertiärstruktur des Proteins sich irreversibel verändert.
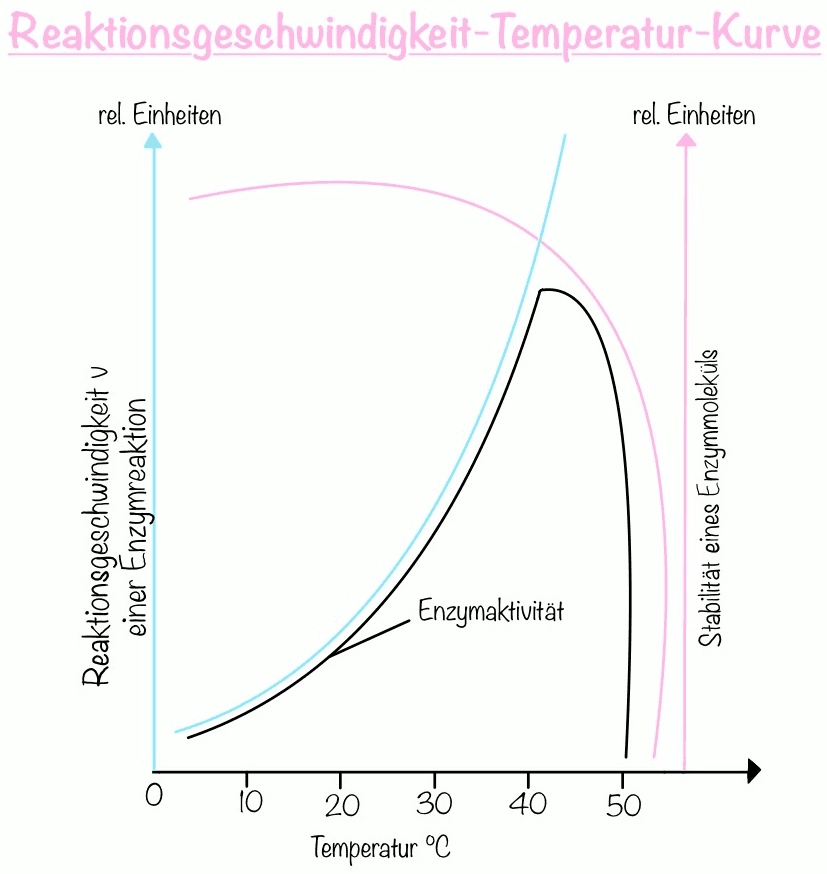
Wichtig zu wissen ist, dass die meisten Enzyme ein Temperaturoptimum haben, um das sich die RGT-Regel abspielt.
Zu Beginn der Reaktion nimmt die Reaktionsgeschwindigkeit mit steigender Temperatur exponentiell zu bis zum Temperaturoptimum. Jede Temperaturerhöhung um 10°C führt zu einer Verdopplung oder Vervielfachung der Reaktionsgeschwindigkeit. Sofern das Temperaturoptimum erreicht ist, nimmt die Enzymaktivität mit weiter steigenden Temperaturen nun exponentiell ab. Die Wechselwirkungen, die zur Stabilität der Tertiärstruktur beitragen werden durch die starke thermische Bewegung überwunden. Als Folge denaturiert das Enzym und verliert seine Form. Das Substrat ist dann nicht mehr in der Lage am aktiven Zentrum zu binden aufgrund der Formänderung des Enzyms. So bleibt das Enzym schließlich inaktiv.
Verwendung und Bedeutung von Biokatalysatoren
Biokatalysatoren können aufgrund ihrer Funktion in unterschiedlichen Bereichen verwendet werden. Sie haben eine große Wichtigkeit für Organismen.
Im Organismus
Stoffwechselprozesse spielen eine große Rolle für alle lebenden Organismen. Daher ist die wichtigste Aufgabe der Biokatalysatoren den Erhalt des Lebens. Zu den Stoffwechselprozessen zählen unter anderem die Fotosynthese und DNA-Replikation und Glykolyse wie andere Prozesse. Außerdem sind Biokatalysatoren in Form von Enzymen unentbehrlich für den Körper. So dienen zum Beispiel Peptidasen, Lipasen und Glykosidasen zur Spaltung von Eiweißen und Fetten bei der Verdauung. Des Weiteren spielen Enzyme im Immunsystem des Menschen eine sehr wichtige Rolle. Sie wirken zum Schutz des Organismus (Beispiel: Serinproteasen) und beteiligen sich an der Reizaufnahme und -weitergabe, denn Rezeptoren mit enzymatischer Wirkung sind auch hier daran beteiligt. Nicht zuletzt geschieht die Hormonaktivierung und -desaktivierung durch Enzyme. So kann also festgehalten werden, dass die Bedingung für das Leben auf Erden das Vorhandensein von Enzymen ist.
In der Industrie
Neben den wichtigen Aufgaben im Organismus haben Biokatalysatoren auch industrielle Zwecke. Die wichtigsten Katalysatoren, die in der Industrie genutzt werden sind Lipasen, Esterasen, Proteasen, Amylasen und Oxidasen. Diese Biokatalysatoren sind in organischen Lösungsmitteln aktiv, daher werden sie nicht nur in wässrigen Reaktionsmedien eingesetzt.
Beispiele für die Nutzung von Biokatalysatoren in der Industrie
- Um die Waschwirkung zu verbessern, werden Lipasen, Proteasen und Amylasen den Wasch- und Spülmitteln zugesetzt. Diese Enzyme können Eiweiße, Fette und Stärke spalten und so die Flecken von der Kleidung und vom Geschirr zersetzen.
- Enzyme und Ribozyme sind wertvoll für die Gentechnik, denn sie können unter anderem dazu beitragen, dass Lebensmittel länger haltbar bleiben.
- Proteasen werden bei der Lederverarbeitung genutzt, da sie wichtig für das Weichen und Enthaaren des Leders sind. Auch für die Milchgerinnung bei der Käseverarbeitung sind Proteasen relevant.
- Nicht zuletzt wird in der medizinischen Diagnostik mit mit enzymatischen Messungen gearbeitet: So befindet sich in einem Teststreifen zur Erkennung von Diabetes ein Enzymsystem. Ein bestimmter Stoff wird von Blutzucker produziert und aus der Konzentration des Stoffes kann der Blutzuckerspiegel gemessen werden.
Beispiele für Biokatalysatoren mit deren Funktionen
Hexokinase
Hexokinase ist das erste Enzym bei der Glykolyse. Es phosphoryliert die Hexosen (Zucker mit sechs Kohlenstoffatome) beim Kohlenstoffwechsel und überführt sie jeweils in Hexosen-Phosphate, z.B. wird Glucose in Glucose-6-Phosphat überführt.
Allgemein sind Hexosen in der Lage Phosphatgruppen von ATP auf das C6-Atom von Hexosen zu übertragen. Ein Beispiel dafür ist die oben genannte Glucose. Mit dem Übertragen der Phosphatgruppen auf das Glucose kann die Glucose nicht mehr aus dem Cytoplasma in das Blut rückdiffundieren. Dieser Vorgang aktiviert auch die Glucose energetisch. Auf diese Art und Weise steht die Glucose für andere Stoffwechselprozesse zur Verfügung.
Hexokinasen werden im Übrigen als Kinasen bei der Durchführung einiger enzymatischer Tests benutzt. Ein Beispiel ist die Verwendung von Hexokinasen beim Bestimmen des Blutzuckerspiegels.
Vorzufinden ist das Enzym nur in Organismen von Wirbeltieren.
Pepsin
Pepsin ist ein wichtiges Verdauungsenzym, das Proteine spaltet. Am besten kann das Enzym seine Wirkung in einem sehr sauren Milieu entfalten. Da der pH-Wert im menschlichen Magen genau zwischen 1-4 liegt, kann sich das Pepsin dort sehr gut einnisten und spaltet dort Proteine aus der Nahrung. Im Magen zerlegt das Enzym Eiweiße in kurzkettige Aminosäuren. So können die Eiweiße besser verwertet werden. Durch die Spaltung der Proteine fördert Pepsin den Muskelaufbau, weshalb Sportler es gern als Nahrungsergänzung einnehmen. Außerdem dient Pepsin als Ergänzungsmittel bei der Verdauung und lindert Magenbeschwerde. Bei der Herstellung von Nahrungsergänzungsmitteln wird nur das aus tierischen Quellen gezogene Pepsin verwendet.
Glucose-Isomerase
Hauptsächlich wandelt dieser Biokatalysator Glucose (Traubenzucker) in Fruchtzucker um. Durch die Reproduktion von genetisch veränderten Mikroorganismen wird Glucose-Isomerase gewonnen. Jedoch bleibt der Biokatalysator genetisch unverändert.
Trypsin
Das Enzym wird von Bauchspeicheldrüse gebildet und gehört zu den wichtigsten Peptidasen des Verdauungssystems. Bei pH-Werten von 7-8 entfaltet Trypsin seine volle Wirksamkeit.
Die Aufgabe von Trypsin besteht darin die Eiweißspaltung, die schon im Magen beginnt, im Dünndarm fortzusetzen. Folgendermaßen werden dem Organismus lebenswichtige Proteine zur Verfügung gestellt. Ebendeswegen kann der Mangel an Trypsin lebensbedrohliche Folgen hervorrufen.
Das Enzym wird auch als Ergänzungsmittel hergestellt, jedoch wird dabei nur mit tierischem Trypsin gearbeitet. Das Präparat stellt eine Kombination von Trypsin mit anderen Enzymen dar. In dieser Form wird die Effizienz um ein Vielfaches verbessert.
Im Körper erfüllt dieser Biokatalysator unterschiedliche Aufgaben:
- Dient der Verdauung der Proteine aus der Nahrung. Durch die Spaltung der Aminosäuren wird eine gute Aufnahme der Eiweiße möglich gemacht.
- Stärkt das Immunsystem durch, z.B. das Abbauen von abgestorbenem Stoffgewebe. Der Körper ist nun verpflichtet diese abgestorbenen Zellen durch neue Zellen zu ersetzen.
- Beschleunigt die Heilung von Wunden. Das Enzym hat nämlich eine entzündungshemmende und heilende Wirkung. Das Trypsin aktiviert zusätzlich die beiden Enzyme Plasmin und Plasminogen, die die Blutgerinnung durch das Hemmen des Klebstoffs fördern.
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik