Chemie
- Details
- Zugriffe: 19649
Name: Sophie Meffert, 2018-04
pH-Wert-Bestimmung mit der pH-Elektrode
Die pH-Elektrode dient der Messung des pH-Wertes, wobei in der Praxis meist mit einer Glaselektrode gearbeitet wird. Eingesetzt wird sie bei der pH-Wert-Messung im Labor, bei der Durchführung von Säure-Base-Titrationen, wie auch bei der pH-Wert-Bestimmung in Aquarien.
Vor der Messung muss die pH-Elektrode kalibriert werden. Dazu wird die Elektrode in mehrere Pufferlösungen (oft pH7 und 11) mit definiertem pH-Wert getaucht und so auf einen bestimmten pH-Wert, den Sollwert, geeicht. Dabei muss angesichts der Temperaturabhängigkeit des pH-Wertes auf die Temperatur des Puffers geachtet werden.
Die Messung erfolgt durch das Eintauchen der Elektrode in die zu untersuchende Lösung, wobei die Temperatur beim ermittelten Messwert anzugeben ist. Weiterhin ist oft eine gewisse Zeit zur Stabilisierung des Messwertes zu erwarten.
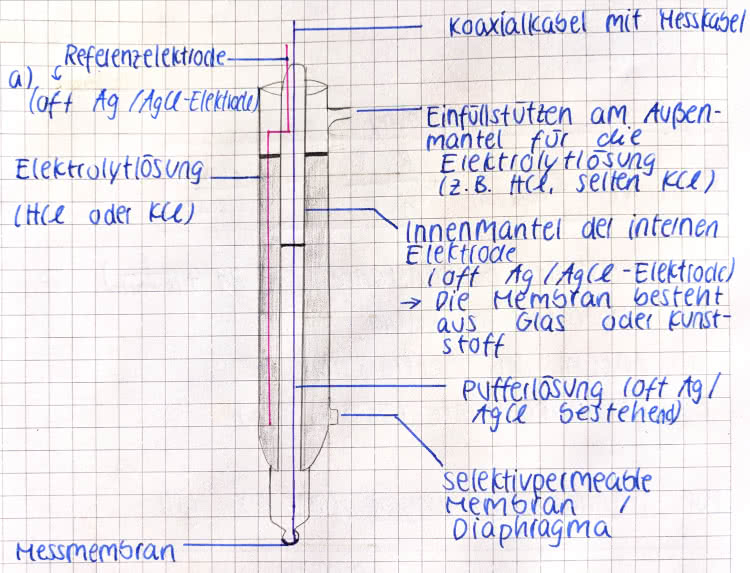
Zum Aufbau der pH-Elektrode:
- Koaxialkabel mit dem Messkabel
- Referenzelektrode
- Einfüllstutzen am Außenmantel für die Elektrolytlösung
- Elektrolytlösung
- Innenmantel der internen Elektrode
- Pufferlösung àpH-Wert ändert sich bei Säure-/Basenzugabe nicht
- Selektivpermeable Membran/Diaphragma àschafft Verbindung zwischen Elektrolyt und Messlösung
- Messmembran

Zur pH-Messung sind zwei Elektroden notwendig: Neben der Glaselektrode selbst wird eine Bezugselektrode benötigt. Meistens werden beide in einer sogenannten Einstabmesskette vereint: Sie besteht aus einem inneren Rohr und einem äußeren Mantel, wobei letzterer als Referenzelektrode dient und aus einem Silberdraht, Silberchlorid und einer Elektrolytlösung (meist Kaliumchlorid) aufgebaut ist. Ebenso befinden sich im inneren Rohr Silberdraht, Silberchlorid und eine Kaliumchloridlösung, die zusätzlich noch einen Puffer enthält. Das innere Rohr ist mit der Glasmembran und somit mit der zu messenden Lösung verbunden, der äußere Mantel wiederum mit einem Diaphragma.
Die Elektrode darf niemals längere Zeit trocken oder in destilliertem Wasser gelagert werden, damit die untere Messmembran nicht austrocknet und somit unwirksam wird.
Messen und berechnen des Elektrodenpotentials einer Wasserstoffhalbzelle
Das betreffende galvanische Element ist also das H3O+ /H2 bzw. H+ /H2 - Element. Es gilt die allgemeine Nernstgleichung als Basis:
0,059 V [Ox]
ΔE(H+/H2) = E0(H+/H2) + ———— · lg ————
n [Red]
n = 2, da zwei Elektronen übertragen werden
Die H+-Ionenkonzentration ist nach dem MWG demzufolge: [H+]2
Die reduzierte Form des Elements Wasserstoff, wird wie üblich gleich 1 gesetzt:
ΔE0 (H+/H2) ist das Standardpotential und ist mit 0 definiert.
0,059 V [H+]2
<=> ΔE(H+/H2) = 0 + ———— · lg ————
2 1
0,059 V [H+]
<=> ΔE(H+/H2) = 0 + ———— · 2 lg ———
2 1
<=> ΔE(H+/H2) = 0,059 V · lg [H+]
Der letzte Abschnitt lg [H+] entspricht ja schon bis auf das Vorzeichen dem pH-Wert: lg [H+] = -pH
=> ΔE(H+/H2) = 0,059 V · (- pH)
bzw: ΔE(H+/H2) = - 0,059 V · pH
Messung des pH-Werts mit einer Bezugselektrode
mithilfe der oben genannten pH-Elektrode wird der pH-Wert nun gegen eine zweite Wasserstoffhalbzelle gemessen:
EMK = E(Kathode) - E(Anode) = 0V - (- 0,059 V · pH) = 0,059 V · pH
EMK
<=> pH = —————
0,059 V
pH-Elektrode (Klicken zum Vergrößern)
- Anorganische Chemie: pH-Wert (und pOH-Wert)
- Anorganische Chemie: Phosphor
- Anorganische Chemie: Photovoltaik und Brennstoffzelle
- Anorganische Chemie: Protolyse von Phosphorsäure
- Anorganische Chemie: Protolysereaktionen bei Salzen (Säure-Base Reaktionen)
- Anorganische Chemie: Reaktion von Säuren und Basen mit Wasser
- Anorganische Chemie: Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
- Anorganische Chemie: Reaktionsgeschwindigkeit, Momentangeschwindigkeit und Messung (sowie HWZ)
- Anorganische Chemie: Reaktionsgeschwindigkeitsmessung von Thiosulfationen mit Säure
- Anorganische Chemie: Redoxreaktionen aufstellen
- Anorganische Chemie: Redoxreaktionen im Alltag
- Anorganische Chemie: Salpetersäure HNO₃ - Herstellung, Verwendung, Eigenschaften
- Anorganische Chemie: Salpetrige Säure
- Anorganische Chemie: Salze
- Anorganische Chemie: Salzherstellung durch Neutralisation
- Anorganische Chemie: Sauerstoff
- Anorganische Chemie: Sauerstoffsäuren des Chlors
- Anorganische Chemie: Sauerstoffsäuren des Phosphors
- Anorganische Chemie: Säure-Base Chemie (Brönsted-Definitionen)
- Anorganische Chemie: Säure-Base-Puffer und Puffersysteme
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik