Chemie
- Details
- Zugriffe: 68203
Namen: Julian Fischer, Jakob Ulmer, David Jestedt, Jannis Pieschner
Namen:Maria, Nils, Max, Phillip
Die Metallbindung
1. Allgemeines
Metalle bzw. Legierungen (Schmelze von mehreren Metallen) haben nur wenige Valenzelektronen.
=> niedrige Ionisierungsenergie zum Entfernen der Elektronen vom Atomkern nötig.
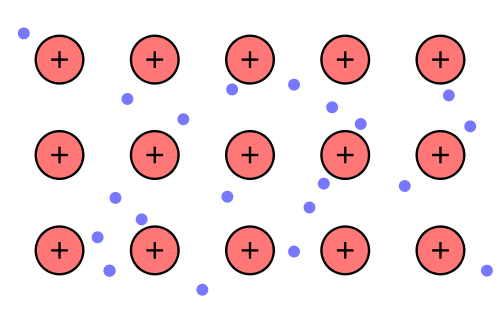
Es entstehen positive Atomrümpfe und Elektronen (negativ).
Quelle Bild: Public Domain by Wikipedia-User ARTE; http://commons.wikimedia.org/wiki/File:Nuvola_di_elettroni.svg
Definition Metallgitter:
Die positiven Atomrümpfe werden von den Elektronen zusammengehalten, die sich frei zwischen den Atomrümpfen bewegen können (delokalisiert).
denn: (positiv und negativ geladene Teilchen ziehen sich an!)
Diese frei beweglichen Elektronen nennt man auch Elektronengas, da sie sich wie Gas bewegen (Modellvorstellung) .
Definition Metallbindung:
Bei Metallen und Legierungen liegt im Gegensatz zur Ionenbindung (Kationen und Anionen) oder zur Elektronenpaarbindung Metallionen und Valenzelektronen der Metalle vor, da die Ionisierungsenergie bei Metallen niedrig ist. Man nennt es auch Elektronengas. (siehe Ionisierungsenergie, Elektronenaffinität und Elektronennegativität)
2. Erklärung der besonderen Eigenschaften von Metallen
Aus dem besonderen Aufbau der Metallverbindung resultieren verschiedene Eigenschaften. Zum Einen erklärt sie die besonderst gute Leitfähigkeit, da die Valenzelektronen frei beweglich sind, zum Anderen erklärt dadurch die Stabilität der Metalle, weil die Elektronen und die Metallkationen sich gegenseitig anziehen. Man kann dadurch auch die Verformbarkeit. Aufgrund der freibeweglichen Elektronen kann man die Metallionen verschieben, ohne dass sich das Umfeld ändert. Es bleibt negativ. Die Elektronen können auch Wärme gut leiten, da Wärme die Bewegung der Teilchen ist. Die Elektronen sind freibeweglich und können sich so gut sich gegenseitig anstossen. (Zum Vergleich mit Ionengitter und Elektronen-Paar-Bindung siehe die dazugehörigen Artikel.)
2.1 Wärmeleitfähigkeit
Bei Wärmezufuhr beginnen die Atome (und Elektronen) im Gitter zu schwingen. Sie stoßen sich dabei gegenseitig an (jeweils die Atome und jeweils die Elektronen). Wenn sie sich abstoßen wird die Wärme in Form von Bewegungsenergie weitergegeben. Bei hohen Temperaturen überwiegt die Energieübertragung durch die Atome; bei niedrigen die durch Elektronen.
2.1.1 Vergleich zu Ionengitter
Im Ionengitter können sich die Atome und Elektronen nicht so gut abstoßen wie im Metallgitter, da sich diese deutlich mehr anziehen und „zusammenhängen“ als im Metallgitter.
=> Metalle sind bessere Wärmeleiter als Ionenverbindungen
2.2 Elektrische Leitfähigkeit
Elektrische Leitfähigkeit ist nichts anderes als Bewegung von Elektronen vom negativen zu positiven Pol.
Wird an das Metall eine Spannung angelegt, passiert genau dies mit den Elektronen im Metall.Dies wird von der Struktur des Metallgitters begünstigt (kanalartig).
Metalle leiten bei hohen Temperaturen schlechter den elektrischen Strom als bei niedrigen, da die Atome bei erhöhter Energiezufuhr anfangen zu schwingen und somit den elektrischen „Fluss“ stören.
2.3 Verformbarkeit
Die Verformbarkeit ist dem Aufbau des Metallgitters geschuldet.Wenn das Gitter verschoben wird kommen die einzelnen Atome immer wieder in die selbe Umgebung (positive Atomrümpfe).
3. Metallgitter bei Legierungen
Legierungen sind mehrere miteinander verschmolzene Metalle.
=> ähnlicher Aufbau wie reine Metalle
Also ist das Metallgitter auch aus unterschiedlichen Atomrümpfen und Elektronen aufgebaut.Dies wirkt sich auch auf die Eigenschaften aus:
Man kann die Atomrümpfe nicht mehr untereinander verschieben sodass die Bindungen noch gut zusammenpassen.
=> schlechtere Verformbarkeit
Beispiel: Eisen ist gut verformbar und weich aber Stahl ist hart.
Die restlichen charakteristischen Eigenschaften von Metallen bleiben größtenteils erhalten.Andere Eigenschaften wie Dichte, Härte und Beständigkeit sind hiervon aber nicht beeinflusst und hängen von den einzelnen Chemikalien ab.
Legierungen
Legierungen sind aus mehreren verschiedenen Metallionen aufgebaut. Deswegen kann man Legierungen nicht sogut verformen, da die unterschiedliche Ladungen nicht zueinander verschoben werden können.(siehe Legierungen)
- Anorganische Chemie: Oxidationsstufen des Mangans
- Anorganische Chemie: Periodensystem (!)
- Anorganische Chemie: pH-Abhängigkeit von Redoxpotentialen (über die Nernst-Gleichung)
- Anorganische Chemie: pH-Elektrode & elektrochemische pH-Wert-Bestimmung
- Anorganische Chemie: pH-Wert (und pOH-Wert)
- Anorganische Chemie: Phosphor
- Anorganische Chemie: Photovoltaik und Brennstoffzelle
- Anorganische Chemie: Protolyse von Phosphorsäure
- Anorganische Chemie: Protolysereaktionen bei Salzen (Säure-Base Reaktionen)
- Anorganische Chemie: Reaktion von Säuren und Basen mit Wasser
- Anorganische Chemie: Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
- Anorganische Chemie: Reaktionsgeschwindigkeit, Momentangeschwindigkeit und Messung (sowie HWZ)
- Anorganische Chemie: Reaktionsgeschwindigkeitsmessung von Thiosulfationen mit Säure
- Anorganische Chemie: Redoxreaktionen aufstellen
- Anorganische Chemie: Redoxreaktionen im Alltag
- Anorganische Chemie: Salpetersäure HNO₃ - Herstellung, Verwendung, Eigenschaften
- Anorganische Chemie: Salpetrige Säure
- Anorganische Chemie: Salze
- Anorganische Chemie: Salzherstellung durch Neutralisation
- Anorganische Chemie: Sauerstoff
- Anorganische Chemie: Sauerstoffsäuren des Chlors
- Anorganische Chemie: Sauerstoffsäuren des Phosphors
- Anorganische Chemie: Säure-Base Chemie (Brönsted-Definitionen)
- Anorganische Chemie: Säure-Base-Puffer und Puffersysteme
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik