Chemie
- Details
- Zugriffe: 58259
Name: Valentin R., 2018-05
Hinweis für die Mittelstufenschüler: Ich verwende in diesem Artikel einen besonderen Reaktionspfeil, den sogenannten Gleichgewichtspfeil. Lasst Euch davon nicht irritieren und stellt Euch einen normalen Reaktionspfeil vor.
(Quantitaive) Neutralisation und Titration
Definition:
Die Neutralisation beschreibt den Vorgang, bei dem eine Säure mit einer Base zu Salz und Wasser reagiert.
Vorgang der Neutralisation:
Die Idee bei der Neutralisation ist es, die ätzenden Protonen (bzw. Oxoniumionen, also H3O+) mit den ätzenden Hydroxidteilchen (also OH-) so auszugleichen, dass unschädliches Wasser (also H2O) und das jeweilige Salz entsteht. Wenn die Neutralisation geglückt ist, zeigt der Universalindikator die Farbe grün an (=eine neutrale Lösung) und der pH-Wert liegt bei 7.
Beispiele für Neutralisationen:
Natronlauge und Salzsäure reagieren zu Wasser und Natriumchlorid:
NaOH + HCl ⇌ H2O + NaCl
Schwefelsäure und Kalilauge reagieren zu Wasser und Kaliumsulfat:
H2SO4 + KOH ⇌ 2 H2O + K2SO4
Phosphorsäure und Kalkwasser reagieren zu Wasser und Calciumphosphat:
2 H3PO4 + 3 Ca(OH)2 ⇌ 6 H2O + Ca3(PO4)2
Quantitative Neutralisation:
Sie beschreibt die mathematische Rechnung mit der man die nötige Volumina oder Konzentration bestimmt.
Erklärung Quantitative Neutralisation an einer Beispielaufgabe mit Natronlauge:
Für die Neutralisation von 50ml Schwefelsäure benötigt man 15ml Natronlauge mit der Konzentration 0,1mol/l. Bestimme die Konzentration der Schwefelsäure.
Wichtig:
Die Formel für die Konzentration muss uns bereits bekannt sein:
c = Konzentration; n = Stoffmenge; V = Volumen
n
c = —
V
Überlegung:
H+ + OH- ⇌ H2O
Wir wissen: Im Neutralpunkt gilt: gleiche Anzahl an H+ und OH-.
Daraus folgt: Stoffmenge Säure = Stoffmenge Lauge, also: nS = nL
n
Es gilt: c = — | · V
V
⇔ c · V = n
nS = nL
∧ ∧
cS · VS = cL · VL
Reaktionsgleichung aufstellen:
Schwefelsäure + Natronlauge ⇌ Wasser + Natriumsulfat
H2SO4 + 2NaOH ⇌ 2H2O + Na2SO4
gesucht: cS
=> 2·cS · VS = cL·VL |:Vs |:2
(Hier kommt die ·2 auf die Seite der Säure, da der Anteil an Säureteilchen 2mal so hoch ist wie der Anteil der Laugenteilchen --->2·nS = nL )
cL · VL
cS = ————
Vs · 2
Zum Schluss muss man noch die Werte einsetzten. (Lösung: cS= 0,015 mol/l)
Titration
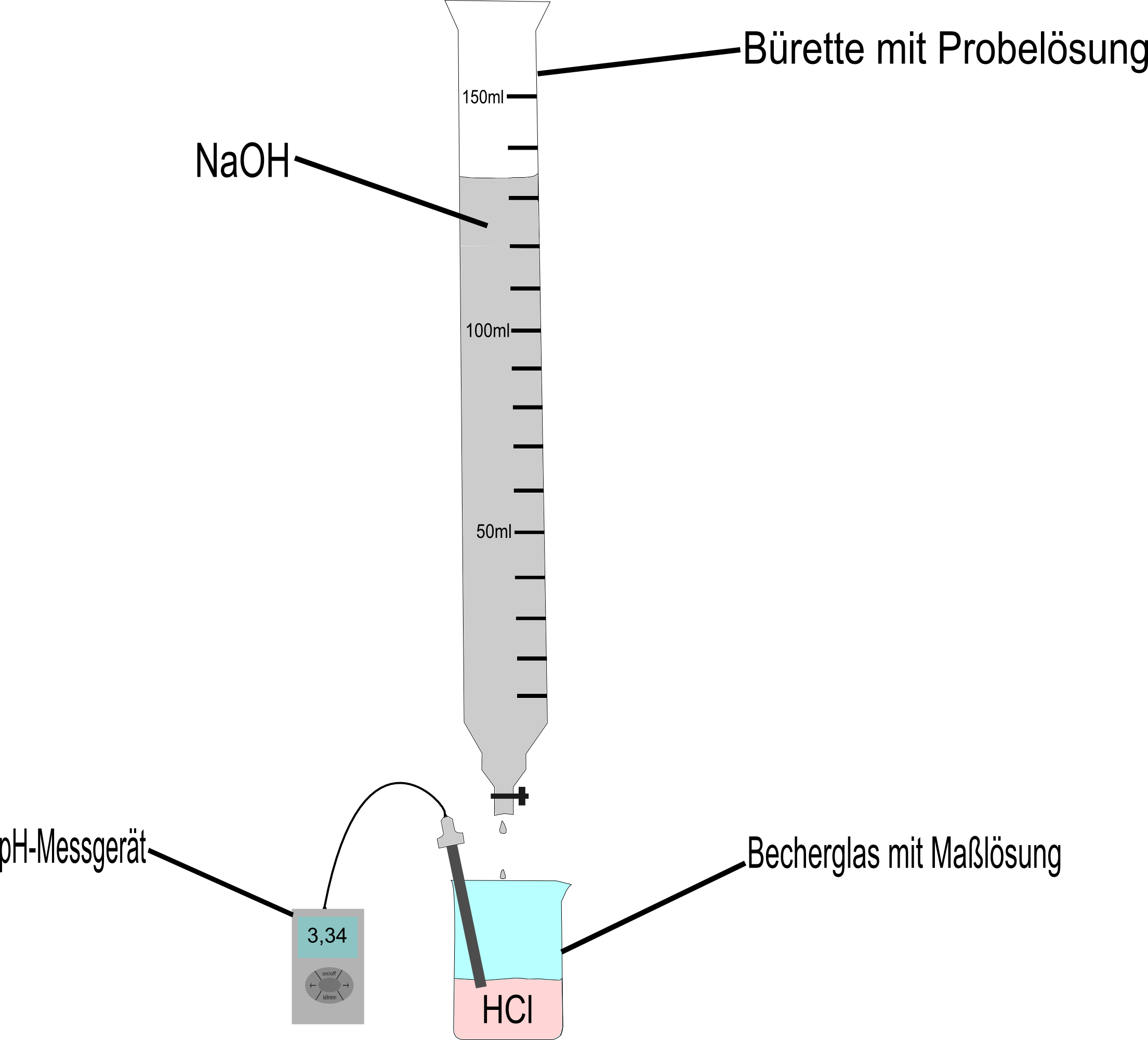
Eine Titration ist nichts anderes als eine Neutralisation zweier Stoffe durch exaktes Abmessen der zu neutralisierenden Stoffe in einem bestimmten chemischen Verfahren. Einen solchen Neutralisationsvorgang kann man zum Beispiel mit Salzsäure(HCl) und Natronlauge(NaOH) durchführen. Dabei wird die Säure (bzw. Lauge) in ein Becherglas gegeben und darauf Schritt für Schritt die Lauge (bzw. Säure) über eine sogenannte Bürette zugetropft.
Hält man nun ein pH-Messgerät in die Lösung im Becherglas oder färbt diese mit dem Universalindikator, so kann man beobachten wie sich der pH-Wert durch das Zutropfen der Lauge (bzw. Säure) langsam ändert.
An der Bürette lässt sich dabei ablesen, wie viel Milliliter zu der Lösung im Becherglas schon zugetropft wurden. In unserem Beispiel wurde die Lauge in die Bürette gefüllt. Ein Versuchsaufbau würde also wie folgt aussehen:
Hat die Lösung im Becherglas den pH-Wert 7 oder färbt der Universalindikator die Lösung grün, so ist diese neutral. Es gilt also Stoffmenge Säure = Stoffmenge Lauge, also: nS = nL.
Der einfache Aufbau einer Titrationsapparatur macht es möglich dieses Verfahren anzuwenden, um mit hoher Genauigkeit in kurzer Zeit die Konzentration eines bekannten Stoffes zu bestimmen.
Angenommen wir wollen die Konzentration einer Salzsäure herausfinden, so lässt sich diese bestimmen, indem wir eine Titration mit Natronlauge durchführen, deren Konzentration bekannt ist. Beispielsweise könnte die Natronlauge eine Konzentration von 1 mol/l haben. Nun geben wir zu einer bestimmten Menge der Lauge (zum Beispiel 100ml) genau so viel Säure hinzu, dass die Lösung neutral ist. Da wir wissen, dass im Neutralpunkt gilt (siehe oben):
Stoffmenge Säure = Stoffmenge Lauge, also: nS = nL können wir nun die Konzentration der zugegebenen Säure berechnen, da wir nS aus nL berechnen können und wir wissen, wie viel Milliliter der Säure hinzu gegeben werden mussten bis die Lösung neutral war(= VS). So lässt sich die Konzentration berechnen mit:
n
c = —
V
Beispielaufgabe:
Berechne die Konzentration einer Salzsäure von der 50ml benötigt wurden um 100ml einer 1 molaren( 1mol/l) Natronlauge zu neutralisieren.
Überlegung:
Im Neutralpunkt gilt nL=nS
---> nL = cL· VL= 1mol/l · 0,1l= 0,1mol = nS
nS 0,1mol
---> cS = —— = ——— = 2mol/l
VS 0,05l
Titrationskurve
Zu jeder Titration lässt sich eine Titrationskurve erstellen. Eine solche Kurve kann wie folgt aussehen:
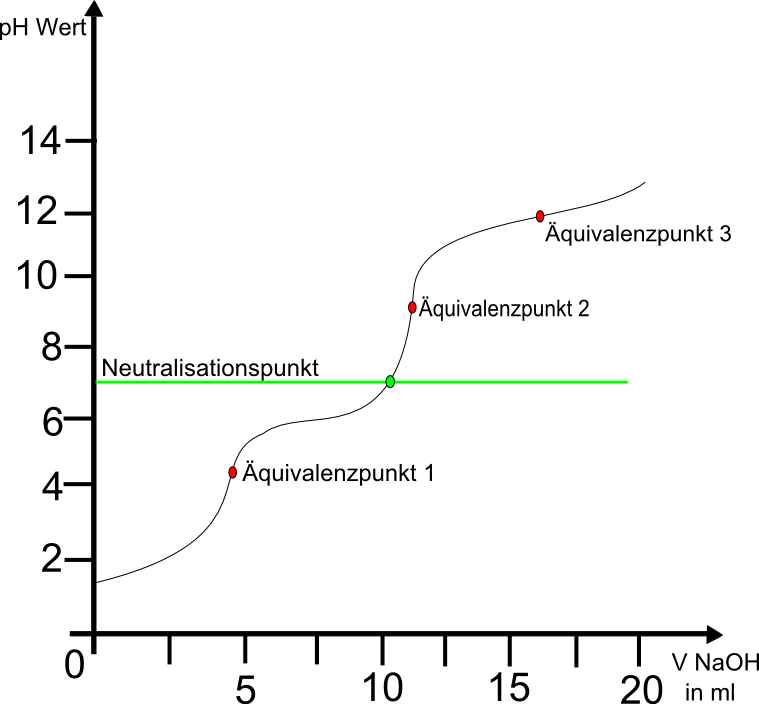
Die Titrationskurve ist ein Graph, der den pH-Wert der Neutralisationslösung in Abhängigkeit von der zugegebenen Base bzw. Säure angibt. An der beispielhaften Titrationskurve für die Neutralisation von 100ml 0,1molarer Salzsäure mit 1 molarer Natronlauge ist zu sehen, dass der pH-Wert der Salzsäure anfangs bei ca. 2 liegt nach der Zugabe von 20ml Natronlauge auf ca 13 steigt.
Deutlich wird eine starke Steigung in der Nähe von 10 ml Basenzugabe. Das liegt daran das dort der sogenannte Äquivalenzpunkt liegt. Bei diesem Punkt ist die Stoffmenge an Säure- und Baseteilchen gleich groß. Der Äquivalenzpunkt ist gleichzeitig der Wendepunkt der Titrationskurve. Hier schlägt die Lösung von der Säure zur Base um, weshalb nur wenige Tropfen der Natronlauge eine starke pH-Wertänderung ausmachen. Der Äquivalenzpunkt ist dabei nicht mit dem Neutralisationspunkt zu verwechseln. Bei der Reaktion einer starken Säure und Base liegt der Äquivalenzpunkt zwar annähernd auf dem Neutralpunkt (also bei pH=7), titriert man allerdings zwei unterschiedlich starke Säuren und Basen miteinander, dann ist der Äquivalenzpunkt nicht neutral. Das liegt daran, dass beispielsweise eine schwache Säure bei Anwesenheit einer starken Base schnell zum korrespondierenden Basenpaar reagiert und so selbst als Base in der Lösung vorliegt. Somit kann bei unterschiedlicher Stärke der Säure und Base der Äquivalenzpunkt vom Neutralpunkt abweichen.
Eine weitere Ausnahme bei der Titration bilden mehrprotonige Säuren, also solche mit mehr als einem Wasserstoff(Elementsymbol H) wie beispielsweise Phosphorsäure (H3PO4), Schwefelsäure (H2SO4) oder Kohlensäure (H2CO3). Da beispielsweise bei Phosphorsäure drei Säure-Base-Reaktionen ablaufen:
I H3PO4 + NaOH ---> H2PO4- + Na+ +H2O
II H2PO4- + NaOH ---> HPO42- + Na+ +H2O
III HPO42- + NaOH ---> PO43- + Na+ +H2O
Somit besitzt die Titrationskurve auch drei Äquivalenzpunkte:
- Anorganische Chemie: Alkalimetalle - Kalium
- Anorganische Chemie: Alkalimetalle - Lithium
- Anorganische Chemie: Alkalimetalle - Natrium
- Anorganische Chemie: Alkalimetalle - Rubidium
- Anorganische Chemie: Aluminium
- Anorganische Chemie: Atome, Atombindung und Moleküle
- Anorganische Chemie: Autoprotolyse und Ionenprodukt des Wassers
- Anorganische Chemie: Azofarbstoffe und die Azokupplung
- Anorganische Chemie: Batterien, Akkus und Knopfzellen
- Anorganische Chemie: Beeinflussung des chemischen Gleichgewichts und das Prinzip von Le Chatelier
- Anorganische Chemie: Berechnung des pH-Werts bei starken und schwachen Säuren & Basen
- Anorganische Chemie: Chemische Gleichgewichte am Korallenriff
- Anorganische Chemie: Chemische Reaktion und Reaktionswärme
- Anorganische Chemie: Das Deacon-Verfahren
- Anorganische Chemie: Das Löslichkeitsprodukt
- Anorganische Chemie: Das Massenwirkungsgesetz
- Anorganische Chemie: Das Orbitalmodell - ein modernes Atommodell
- Anorganische Chemie: Der Einfluss der Konzentration auf die Reaktionsgeschwindigkeit & deren Bestimmung
- Anorganische Chemie: Der Protolysegrad von Säuren und Basen
- Anorganische Chemie: Der Springbrunnenversuch (mit HCl und NH3)
- Anorganische Chemie: Die Normalwasserstoffhalbzelle und die Spannungsreihe
- Anorganische Chemie: Edelgase - Argon
- Anorganische Chemie: Edelgase - Helium
- Anorganische Chemie: Edelgase - Neon
- Anorganische Chemie: Edelgase - Radon
- Anorganische Chemie: Edelgase - Xenon
- Anorganische Chemie: Einflussfaktoren auf die Reaktionsgeschwindigkeit
- Anorganische Chemie: Elektrolyse
- Anorganische Chemie: Elektrolyte in der Elektrochemie
- Anorganische Chemie: Energie, Enthalpie & Entropie chemischer Reaktionen
- Anorganische Chemie: Entropie
- Anorganische Chemie: Erdalkalimetalle - Barium
- Anorganische Chemie: Erdalkalimetalle - Beryllium
- Anorganische Chemie: Erdalkalimetalle - Calcium
- Anorganische Chemie: Erdalkalimetalle - Magnesium
- Anorganische Chemie: Erdalkalimetalle - Strontium
- Anorganische Chemie: Erstellen von Valenzstrichformeln / Lewis-Formeln
- Anorganische Chemie: Freie Enthalpie, Gibbs-Helmholtz und Reaktions- und Bildungsenthalpie
- Anorganische Chemie: Galvanisches Element & Daniell-Element
- Anorganische Chemie: Gasgleichgewichte, Kp und das MWG
- Anorganische Chemie: Halogene - Astat
- Anorganische Chemie: Halogene - Brom
- Anorganische Chemie: Halogene - Chlor
- Anorganische Chemie: Halogene - Iod
- Anorganische Chemie: Heterogene Katalyse
- Anorganische Chemie: Historische Entwicklung des Säure-Base-Begriffs (Arrhenius & Brönstedt)
- Anorganische Chemie: Innere Energie, Enthalpie und Verbrenungsenthalpien
- Anorganische Chemie: Ionen und Ionenbildung
- Anorganische Chemie: Ionisierungsenergie, Elektroaffinität und Elektronegativität
- Anorganische Chemie: Ist Natronlauge eine Base? (Protolyse)
- Anorganische Chemie: Katalysator und Katalyse
- Anorganische Chemie: Kollisionsmodell & Stoßtheorie
- Anorganische Chemie: Konzentrationselemente und die Nernstgleichung (noch frei)
- Anorganische Chemie: Krypton
- Anorganische Chemie: Kupfer und Kupfergewinnung
- Anorganische Chemie: Legierungen
- Anorganische Chemie: Löslichkeit und Löslichkeitsgleichgewichte
- Anorganische Chemie: Metalle - Alkalimetalle
- Anorganische Chemie: Metalle - Allgemeine Übersicht, Eigenschaften, Verwendung
- Anorganische Chemie: Metalle - Aluminium und Aluminiumverbindungen
- Anorganische Chemie: Metalle - Eisen und Eisenverbindungen
- Anorganische Chemie: Metalle - Erdalkalimetalle
- Anorganische Chemie: Metalle - Gold
- Anorganische Chemie: Metalle - Korrosion und Korrosionsschutz
- Anorganische Chemie: Metalle - Kupfer und Kupferverbindungen
- Anorganische Chemie: Metalle - Uran
- Anorganische Chemie: Metalle und die Metallbindung
- Anorganische Chemie: Oxidationsstufen des Mangans
- Anorganische Chemie: Periodensystem (!)
- Anorganische Chemie: pH-Abhängigkeit von Redoxpotentialen (über die Nernst-Gleichung)
- Anorganische Chemie: pH-Elektrode & elektrochemische pH-Wert-Bestimmung
- Anorganische Chemie: pH-Wert (und pOH-Wert)
- Anorganische Chemie: Phosphor
- Anorganische Chemie: Photovoltaik und Brennstoffzelle
- Anorganische Chemie: Protolyse von Phosphorsäure
- Anorganische Chemie: Protolysereaktionen bei Salzen (Säure-Base Reaktionen)
- Anorganische Chemie: Reaktion von Säuren und Basen mit Wasser
- Anorganische Chemie: Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
- Anorganische Chemie: Reaktionsgeschwindigkeit, Momentangeschwindigkeit und Messung (sowie HWZ)
- Anorganische Chemie: Reaktionsgeschwindigkeitsmessung von Thiosulfationen mit Säure
- Anorganische Chemie: Redoxreaktionen aufstellen
- Anorganische Chemie: Redoxreaktionen im Alltag
- Anorganische Chemie: Salpetersäure HNO₃ - Herstellung, Verwendung, Eigenschaften
- Anorganische Chemie: Salpetrige Säure
- Anorganische Chemie: Salze
- Anorganische Chemie: Salzherstellung durch Neutralisation
- Anorganische Chemie: Sauerstoff
- Anorganische Chemie: Sauerstoffsäuren des Chlors
- Anorganische Chemie: Sauerstoffsäuren des Phosphors
- Anorganische Chemie: Säure-Base Chemie (Brönsted-Definitionen)
- Anorganische Chemie: Säure-Base-Puffer und Puffersysteme
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff