Chemie
- Details
- Zugriffe: 54019
Name: Kilian Wessel
Die Atombindung
Einzelne Wasserstoffatome
Das Wasserstoffatom besitzt nur ein Elektron. Seine negative Ladung ist über den ganzen Raum verteilt. Man spricht deshalb von einer sogennanten Elektronenwolke. Dabei handelt es sich jedoch nur um ein Elektron.
Bindung eines Wasserstoffmoleküls
Wenn sich zwei Wasserstoffatome nähern, so durchdringen sie ihre Elektronenwolken. Die Stärke der Durchdringung hängt hierbei von dem Abstand zwischen den Atomkernen ab: Ist der Abstand zwischen den Atomkernen kleiner, so ist die Durchdrinung stärker.
Die Elektronen befinden sich nun zwischen den beiden Kernen.
Außerdem entsteht eine gemeinsame Elektronenwolke um beide Atomkerne. Dort befinden sich zwei Elektronen. Durch diese Elektronenwolke, werden die Wasserstoffatome zusammengehalten und bilden ein Wasserstoffmolekül. Diese Bindung nennt man Atombindung.
Bindungsenergie
Wenn ein Wasserstoffmolekül gebildet wird, so wird Energie frei. Diese Energie nennt man Bindungsenergie. Will man die Atome wieder trennen, so wird die selbe Energie benötigt. Ein Wasserstoffmolekül ist stabiler als die beiden einzelnen Wasserstoffatome.
Valenzstrichformel
Die Valenzstrichformel wird oft verwendet, um die Moleküle darzustellen. Hierbei werden alle Elektronenpaare dargestellt (bindende und nicht bindende). Will man die Valenzstrichformel aufstellen, so sind folgende Regeln zu beachten:
- Zunächst schreibt man die Elementsymbole der Atome auf.
- Danach werden alle Valenzelektronen der einzelnen Atome gezeichnet. Man denkt sich nun vier Elektronenwolken, die zunächst mit je einem Elektron besetzt sind und -wenn nötig- danach mit je noch einem Elektron besetzt werden können. Wichtig hierbei ist, dass eine Elektronenwolke maximal zwei Elektronen besitzen kann.
Beispiel: Das Fluoratom (F) hat ein einzelnes Valenzelektron und drei Valenzelektronenpaare.
Ausnahme: Das Heliumatom (HE) steht in der VIII. Hauptgruppe, hat jedoch nur zwei Valenzelektronen, also ein Elektronenpaar.
- Jetzt wird das Molekül gebildet. Um dies zu machen, werden je zwei einzelne Valenzelektronen zu einem bindenden Elektronenpaar gepaart. Die bindende Elektronen Paare stehen dann zwischen den beiden bindenden Atomen.
Beispiel: H-H
Die überbleibenden Elektronenpaare bezeichnet man als nicht bindende Elektronenpaare.
Mehrfachbindungen
Eine Mehrfachbindung ist eine Elektronenpaarbindung, bei der zwei Atome nicht nur durch ein Elektronenpaar verbunden sind, sondern durch mehrere.
Die polare Atombindung
Die Bindung im Hydrogenchloridmolekül
Da sich die Elemente Chlor und Wasserstoff in ihrer Elektronegativität unterscheiden (Chlor = relativ hohe Elektronegativität [EN(Cl) = 3,0] / Wasserstoff = geringere Elektronegativität [EN(H) = 2,1]), werden die Bindungselektronen vom Chloratom stärker angezogen. Darauf folgt, dass das Chloratom einen Überschuss an negative Ladung besitzt. Dadurch hat das Wasserstoffatom einen Mangel an negativer Ladung, sodass die positive Ladung seines Atomkerns überwiegt. Folglich hat das Hydrogenchloridmolekül einen "Pluspol" sowie einen "Minuspol"
=> Dipolmolekül
Eine polare Atombindung liegt also dann vor, wenn in einem Molekül Atome verschiedener Elektronegativität verbunden sind.
Polarität der Bindung
Die Elektronegativitätsdifferenz zwischen den beiden Atomen gibt an, wie groß die Polarität der Bindung ist. Je größer die Elektronegativitätsdifferenz, desto größer die Polarität der Bindung.
Der räumliche Bau von Molekülen
VSEPR-Modell
Das VSEPR-Modell (VSEPR ist die Abkürzung für englisch valence shell electron pair repulsion, deutsch Valenzschalen-Elektronenpaar-Abstoßung), auch EPA-Modell (Elektronenpaarabstoßungsmodell) oder ursprünglich auch VEPR-Theorie (englisch valence electron pair repulsion theory), führt die räumliche Gestalt eines Moleküls auf die abstoßenden Kräfte zwischen den Elektronenpaaren der Valenzschale zurück.
Hier sind einige Beispiele:
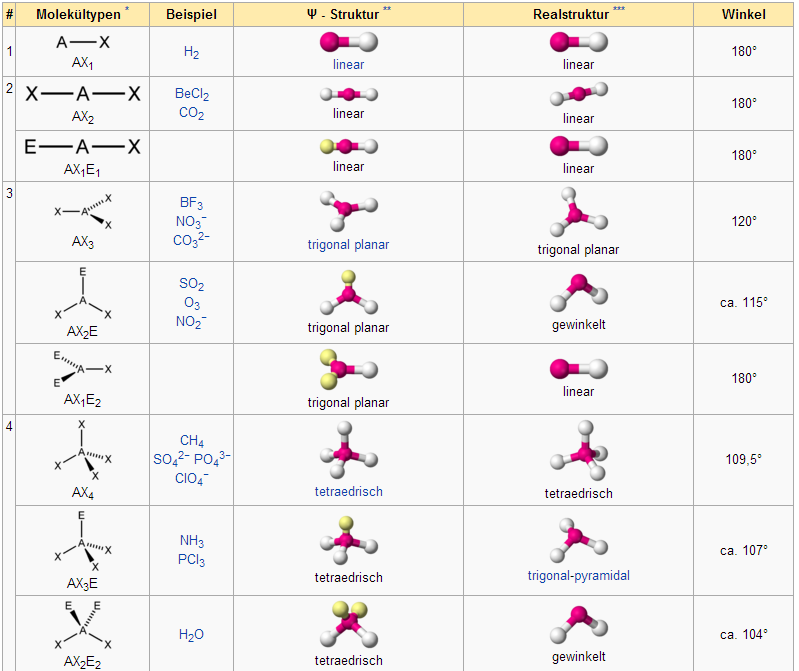
Molekültypen und Molekülgeometrie (Klicken zum Vergrößern)
Quelle: Public domain: http://de.wikipedia.org/wiki/VSEPR-Modell, Mehrere Autoren
Es werden nicht nur die bindenden Elektronenpaare berücksichtigt, sondern auch die nicht bindenden Elektronenpaare.
- Anorganische Chemie: Autoprotolyse und Ionenprodukt des Wassers
- Anorganische Chemie: Azofarbstoffe und die Azokupplung
- Anorganische Chemie: Batterien, Akkus und Knopfzellen
- Anorganische Chemie: Beeinflussung des chemischen Gleichgewichts und das Prinzip von Le Chatelier
- Anorganische Chemie: Berechnung des pH-Werts bei starken und schwachen Säuren & Basen
- Anorganische Chemie: Chemische Gleichgewichte am Korallenriff
- Anorganische Chemie: Chemische Reaktion und Reaktionswärme
- Anorganische Chemie: Das Deacon-Verfahren
- Anorganische Chemie: Das Löslichkeitsprodukt
- Anorganische Chemie: Das Massenwirkungsgesetz
- Anorganische Chemie: Das Orbitalmodell - ein modernes Atommodell
- Anorganische Chemie: Der Einfluss der Konzentration auf die Reaktionsgeschwindigkeit & deren Bestimmung
- Anorganische Chemie: Der Protolysegrad von Säuren und Basen
- Anorganische Chemie: Der Springbrunnenversuch (mit HCl und NH3)
- Anorganische Chemie: Die Normalwasserstoffhalbzelle und die Spannungsreihe
- Anorganische Chemie: Edelgase - Argon
- Anorganische Chemie: Edelgase - Helium
- Anorganische Chemie: Edelgase - Neon
- Anorganische Chemie: Edelgase - Radon
- Anorganische Chemie: Edelgase - Xenon
- Anorganische Chemie: Einflussfaktoren auf die Reaktionsgeschwindigkeit
- Anorganische Chemie: Elektrolyse
- Anorganische Chemie: Elektrolyte in der Elektrochemie
- Anorganische Chemie: Energie, Enthalpie & Entropie chemischer Reaktionen
- Anorganische Chemie: Entropie
- Anorganische Chemie: Erdalkalimetalle - Barium
- Anorganische Chemie: Erdalkalimetalle - Beryllium
- Anorganische Chemie: Erdalkalimetalle - Calcium
- Anorganische Chemie: Erdalkalimetalle - Magnesium
- Anorganische Chemie: Erdalkalimetalle - Strontium
- Anorganische Chemie: Erstellen von Valenzstrichformeln / Lewis-Formeln
- Anorganische Chemie: Freie Enthalpie, Gibbs-Helmholtz und Reaktions- und Bildungsenthalpie
- Anorganische Chemie: Galvanisches Element & Daniell-Element
- Anorganische Chemie: Gasgleichgewichte, Kp und das MWG
- Anorganische Chemie: Halogene - Astat
- Anorganische Chemie: Halogene - Brom
- Anorganische Chemie: Halogene - Chlor
- Anorganische Chemie: Halogene - Iod
- Anorganische Chemie: Heterogene Katalyse
- Anorganische Chemie: Historische Entwicklung des Säure-Base-Begriffs (Arrhenius & Brönstedt)
- Anorganische Chemie: Innere Energie, Enthalpie und Verbrenungsenthalpien
- Anorganische Chemie: Ionen und Ionenbildung
- Anorganische Chemie: Ionisierungsenergie, Elektroaffinität und Elektronegativität
- Anorganische Chemie: Ist Natronlauge eine Base? (Protolyse)
- Anorganische Chemie: Katalysator und Katalyse
- Anorganische Chemie: Kollisionsmodell & Stoßtheorie
- Anorganische Chemie: Konzentrationselemente und die Nernstgleichung (noch frei)
- Anorganische Chemie: Krypton
- Anorganische Chemie: Kupfer und Kupfergewinnung
- Anorganische Chemie: Legierungen
- Anorganische Chemie: Löslichkeit und Löslichkeitsgleichgewichte
- Anorganische Chemie: Metalle - Alkalimetalle
- Anorganische Chemie: Metalle - Allgemeine Übersicht, Eigenschaften, Verwendung
- Anorganische Chemie: Metalle - Aluminium und Aluminiumverbindungen
- Anorganische Chemie: Metalle - Eisen und Eisenverbindungen
- Anorganische Chemie: Metalle - Erdalkalimetalle
- Anorganische Chemie: Metalle - Gold
- Anorganische Chemie: Metalle - Korrosion und Korrosionsschutz
- Anorganische Chemie: Metalle - Kupfer und Kupferverbindungen
- Anorganische Chemie: Metalle - Uran
- Anorganische Chemie: Metalle und die Metallbindung
- Anorganische Chemie: Oxidationsstufen des Mangans
- Anorganische Chemie: Periodensystem (!)
- Anorganische Chemie: pH-Abhängigkeit von Redoxpotentialen (über die Nernst-Gleichung)
- Anorganische Chemie: pH-Elektrode & elektrochemische pH-Wert-Bestimmung
- Anorganische Chemie: pH-Wert (und pOH-Wert)
- Anorganische Chemie: Phosphor
- Anorganische Chemie: Photovoltaik und Brennstoffzelle
- Anorganische Chemie: Protolyse von Phosphorsäure
- Anorganische Chemie: Protolysereaktionen bei Salzen (Säure-Base Reaktionen)
- Anorganische Chemie: Reaktion von Säuren und Basen mit Wasser
- Anorganische Chemie: Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
- Anorganische Chemie: Reaktionsgeschwindigkeit, Momentangeschwindigkeit und Messung (sowie HWZ)
- Anorganische Chemie: Reaktionsgeschwindigkeitsmessung von Thiosulfationen mit Säure
- Anorganische Chemie: Redoxreaktionen aufstellen
- Anorganische Chemie: Redoxreaktionen im Alltag
- Anorganische Chemie: Salpetersäure HNO₃ - Herstellung, Verwendung, Eigenschaften
- Anorganische Chemie: Salpetrige Säure
- Anorganische Chemie: Salze
- Anorganische Chemie: Salzherstellung durch Neutralisation
- Anorganische Chemie: Sauerstoff
- Anorganische Chemie: Sauerstoffsäuren des Chlors
- Anorganische Chemie: Sauerstoffsäuren des Phosphors
- Anorganische Chemie: Säure-Base Chemie (Brönsted-Definitionen)
- Anorganische Chemie: Säure-Base-Puffer und Puffersysteme
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
