Chemie
- Details
- Zugriffe: 20729
Name: H. Schmitt
Was versteht man unter eine Elektrolyse?
Die Elektrolyse kann als das Gegenteil der Ionenbildung (Aus elementen werden Ionen) verstanden werden. Es werden aus Ionen Elemente gebildet.
Lyse heißt dabei "Spaltung". Bei der Elektrolyse wird mithilfe von Strom ein ionogener Stoff so zerlegt, dass dabei wieder seine Elemente entstehen. Aus Natriumfluorid wird also Natrium und Fluor.
Der ursprüngliche Stoff, oft ei Salz oder Oxid liegt als Flüssigkeit (geschmolzen) oder als Salzlösung vor. Man nennt dies auch einen Leiter 2. Ordnung. Es liegen also bewegliche Ladungsträger (= Ionen) vor.
Die Elektrolyse ist der endotherme Vorgang zur Umwandlung von Ionen in Elemente. Die dabei gewonnen Elemente sind oft chemisch sehr rein. Auf diesem Wege kann man gut unedle und reine Metalle herstellen.
Der Ablauf der Elektrolyse:
Nehmen wir einmal an, wir haben eine wässrige Salzlösung. In einen Behälter oder ein Becherglas kommen zwei Graphitstäbe rein, welche mit einer Gleichstromquelle verbunden sind. Der eine Graphitstab stellt die Anode da dar und ist positiv geladen (Anode ist griechisch und kommt von anodos, was Aufgang bedeutet). Der andere Stab ist die Kathode, welche negativ geladen ist (Kathode ist ebenfalls griechisch und kommt von kathodos, was abwärts führender Weg bedeutet).
An der Anode befinden sich die positiv geladenen Ionen (Definition siehe Ionen und Ionenbildung) welche mit einem + gekennzeichnet sind . Diese wandern in der wässrigen Salzlösung auf die gegenüberliegende Seite. An der Kathode, welche negativ geladen ist entladen sie sich, das heißt, sie nehmen ein Elektron auf und werden so zu ungeladenen Atomen, da sich die positive und die negative Ladung jetzt (wieder) ausgleichen.
An der Kathode befinden sich die negativ geladenen Ionen welche mit einem - gekennzeichnet sind. Diese wandern jetzt zur Anode, welche ja positiv geladen ist und geben ein Elektron ab und werden ebenfalls zu ungeladenen Atomen, da sich auch hier jetzt (wieder) die positive und die negative Ladung ausgleichen. Wichtig ist, das am Ende wieder Elemente gebildet werden. Dieser chemische Vorgang findet nur unfreiwillig statt. Energie muss also die ganze Zeit zugefügt werden. Man sagt auch, die Reaktion ist endotherm.
Die Elektrolyse ist also die Umkehrung der Ionenbildung. Wichtig ist, dass dies unfreiwillig geschieht, da die Ionen eigentlich gar nicht auseinander "wollen". Das heißt, es ist viel Energie notwendig, was zeigt, das Elektrolysen endotherme Reaktionen sind.
Beispiele für Elektrolysen
Natriumchlorid (Kochsalz) wird zuerst in Natrium = Na+ und Chlorid = Cl- zerlegt bzw. gespalten.
Im Kapitel Ionen und Ionenbildung haben wir erfahren, das bei der Ionenbildung das Natriumion ein Valenzelektron hat, welches es an Chlor abgibt, welches sieben Valenzelektronen besitzt. Somit haben Natrium und Chlor das Ziel der Edelgaskonfiguration erreicht, also eine volle Außenschale (meist acht Elektronen). Somit hat Natrium ein Elektron weniger als vorher und wird zum positiv geladenen Ion (+). Chlor hat ein Elektron mehr als vorher und wird zum negativ geladenen Ion (-).
Der folgende Schritt findet nun in einem Behälter mit zwei Graphitstäben statt. Der eine ist die Anode der andere die Kathode. Die Natriumionen wandern zur Kathode, wo sie sich entladen und ein negatives Elektron aufnehmen. Ihre Ladung ist ab jetzt wieder ausgeglichen, das heißt sie sind neutral geladene Natriumatome.
Die Chlorionen machen genau das Gegenteil. Sie wandern zur Anode, wo sie ein negatives Elektron abgeben und auch wieder zu ungeladenen Chloratomen werden. Durch die Schmelze und den elektrischen Strom sind aus Ionen wieder Atome geworden. Aus Natriumchlorid ist wieder Natrium und Chlor entstanden.
Reaktionsgleichung: Na+ + e- ---> Na 2Cl- ---> Cl2 + 2e-
Die Elektrolyse anhand Kupferchlorid zu Kupfer und Chlor
Wir haben wieder einen Behälter mit zwei Graphitstäben der Anode und der Kathode. An der Anode befinden sich die Kupferionen, welche posítiv geladen sind. Diese wandern zur Kathode. Dort entladen sie sich und nehmen ein negatives Elektron auf. Sie werden zu ungeladenen Kupferatomen. Die Chlorionen, welche negativ geladen sind wandern zur Anode, wo sie ein negatives Elektron abgeben. Sie werden zu ungeladenen Chlormolekülen. Somit ist wieder durch die Schmelze und den elektrischen Strom Kupfer und Chlor geworden. Hierbei wird wieder sehr viel Energie benötigt = endotherm und unfreiwillig =)
Reaktionsgleichung: 2Cl- ---> Cl2 + 2e-
Cu2+ + 2e- ---> Cu
------------------------------
2Cl- + Cu2+ ---> Cl2 + Cu
Ion + Ion ---> Element + Element
Eine besondere ANwendung kann hierbei übrigens die Verkupferung sein. Wenn man als Minuspol nicht eine Eltrode aus Graphit nimmt, sondern einen Metallschlüssel, wie den links im Bild, dann setzten sich auf diesem die blauen Kupferionen ab und reagieren durch die Elektronen zu elementarem Kupfer. Dieses bildet, wenn der Schlüssel gut gereinigt war, zu einem festem, rotbraunem Überzug!

Herstellung von Aluminium aus Bauxit in der Schmelzflusselektrolyse
(Bauxit entspricht weitgehend dem Aluminiumoxid (Al2O3)
Wir haben wieder einen Behälter mit einer Stromquelle, zwei Graphitstäben (Anode+ Kathode) und geschmolzenem Al2O3. Die Al3+-Ionen wandern zur Kathode, wo sie ein negatives Elektron aufnehmen und zu ungeladenen Aluminiumatomen werden. An der Anode befinden sich die Oxidionen. Es sind immer jeweils zwei, die zusammenhängen. An der Anode gehen immer vier e- nach oben bzw. sind bereit von den Aluminiumionen aufgenommen zu werden. Die Oxidionen wandern zur Anode, wo sie ein negatives Elektron abgeben und zu ungeladenen Oxidatomen werden.
Reaktionsgleichung:
ox: 2O2- ---> O2 + 4e- |*3
red: Al3+ + 3e- ---> Al |*4
----------------------------------------
Redox: 6O2- + 4Al3+ ---> 302 + 4Al
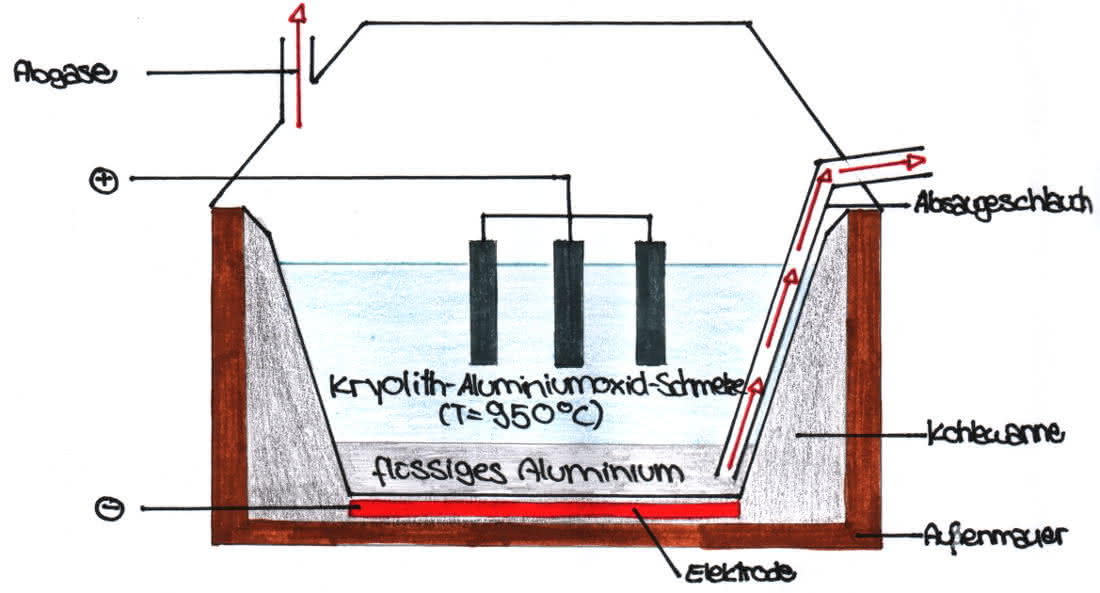
Skizze der Schmelzflusselektrolyse
- Anorganische Chemie: Elektrolyte in der Elektrochemie
- Anorganische Chemie: Energie, Enthalpie & Entropie chemischer Reaktionen
- Anorganische Chemie: Entropie
- Anorganische Chemie: Erdalkalimetalle - Barium
- Anorganische Chemie: Erdalkalimetalle - Beryllium
- Anorganische Chemie: Erdalkalimetalle - Calcium
- Anorganische Chemie: Erdalkalimetalle - Magnesium
- Anorganische Chemie: Erdalkalimetalle - Strontium
- Anorganische Chemie: Erstellen von Valenzstrichformeln / Lewis-Formeln
- Anorganische Chemie: Freie Enthalpie, Gibbs-Helmholtz und Reaktions- und Bildungsenthalpie
- Anorganische Chemie: Galvanisches Element & Daniell-Element
- Anorganische Chemie: Gasgleichgewichte, Kp und das MWG
- Anorganische Chemie: Halogene - Astat
- Anorganische Chemie: Halogene - Brom
- Anorganische Chemie: Halogene - Chlor
- Anorganische Chemie: Halogene - Iod
- Anorganische Chemie: Heterogene Katalyse
- Anorganische Chemie: Historische Entwicklung des Säure-Base-Begriffs (Arrhenius & Brönstedt)
- Anorganische Chemie: Innere Energie, Enthalpie und Verbrenungsenthalpien
- Anorganische Chemie: Ionen und Ionenbildung
- Anorganische Chemie: Ionisierungsenergie, Elektroaffinität und Elektronegativität
- Anorganische Chemie: Ist Natronlauge eine Base? (Protolyse)
- Anorganische Chemie: Katalysator und Katalyse
- Anorganische Chemie: Kollisionsmodell & Stoßtheorie
- Anorganische Chemie: Konzentrationselemente und die Nernstgleichung (noch frei)
- Anorganische Chemie: Krypton
- Anorganische Chemie: Kupfer und Kupfergewinnung
- Anorganische Chemie: Legierungen
- Anorganische Chemie: Löslichkeit und Löslichkeitsgleichgewichte
- Anorganische Chemie: Metalle - Alkalimetalle
- Anorganische Chemie: Metalle - Allgemeine Übersicht, Eigenschaften, Verwendung
- Anorganische Chemie: Metalle - Aluminium und Aluminiumverbindungen
- Anorganische Chemie: Metalle - Eisen und Eisenverbindungen
- Anorganische Chemie: Metalle - Erdalkalimetalle
- Anorganische Chemie: Metalle - Gold
- Anorganische Chemie: Metalle - Korrosion und Korrosionsschutz
- Anorganische Chemie: Metalle - Kupfer und Kupferverbindungen
- Anorganische Chemie: Metalle - Uran
- Anorganische Chemie: Metalle und die Metallbindung
- Anorganische Chemie: Oxidationsstufen des Mangans
- Anorganische Chemie: Periodensystem (!)
- Anorganische Chemie: pH-Abhängigkeit von Redoxpotentialen (über die Nernst-Gleichung)
- Anorganische Chemie: pH-Elektrode & elektrochemische pH-Wert-Bestimmung
- Anorganische Chemie: pH-Wert (und pOH-Wert)
- Anorganische Chemie: Phosphor
- Anorganische Chemie: Photovoltaik und Brennstoffzelle
- Anorganische Chemie: Protolyse von Phosphorsäure
- Anorganische Chemie: Protolysereaktionen bei Salzen (Säure-Base Reaktionen)
- Anorganische Chemie: Reaktion von Säuren und Basen mit Wasser
- Anorganische Chemie: Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
- Anorganische Chemie: Reaktionsgeschwindigkeit, Momentangeschwindigkeit und Messung (sowie HWZ)
- Anorganische Chemie: Reaktionsgeschwindigkeitsmessung von Thiosulfationen mit Säure
- Anorganische Chemie: Redoxreaktionen aufstellen
- Anorganische Chemie: Redoxreaktionen im Alltag
- Anorganische Chemie: Salpetersäure HNO₃ - Herstellung, Verwendung, Eigenschaften
- Anorganische Chemie: Salpetrige Säure
- Anorganische Chemie: Salze
- Anorganische Chemie: Salzherstellung durch Neutralisation
- Anorganische Chemie: Sauerstoff
- Anorganische Chemie: Sauerstoffsäuren des Chlors
- Anorganische Chemie: Sauerstoffsäuren des Phosphors
- Anorganische Chemie: Säure-Base Chemie (Brönsted-Definitionen)
- Anorganische Chemie: Säure-Base-Puffer und Puffersysteme
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
